
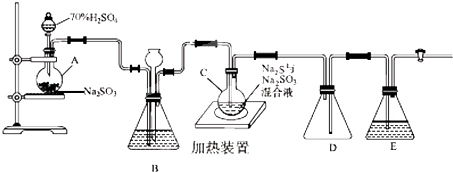
分析 A中的亞硫酸鈉中加入濃硫酸生成二氧化硫,裝置B的作用之一是觀察SO2的生成速率,為提高產品純度,應使燒瓶C中Na2S和Na2SO3恰好完全反應,燒瓶C中發生反應如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)$\frac{\underline{\;△\;}}{\;}$Na2S2O3(aq) (Ⅲ)
反應終止后,燒瓶C中的溶液經蒸發濃縮、冷卻結晶即可析出Na2S2O3•5H2O,E中盛放NaOH溶液進行尾氣處理,防止含硫化合物排放在環境中,
(1)利用液面差在一段時間不變檢驗氣密性,D可防止液體倒吸,E中盛放NaOH溶液進行尾氣處理;
(2)C中Na2S和Na2SO3恰好完全反應,結合燒杯C中的反應分析;
(3)觀察SO2的生成速率,發生強酸制取弱酸的反應,為使SO2緩慢進入燒瓶C,應控制B中硫酸的加入速度,Ⅲ中發生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反應達到終點是S完全溶解,燒杯、錐形瓶需要加熱時必須使用石棉網,蒸發皿、試管可直接加熱;
(4)檢測產品中是否存在Na2SO4,先加鹽酸排除干擾,再利用氯化鋇檢驗硫酸根離子.
解答 解:(1)儀器組裝完成后,關閉兩端活塞,向裝置B中的長頸漏斗內注入液體至形成一段液柱,若液柱高度保持不變,則氣密性良好,D中左側為短導管可防止液體倒吸,E中盛放NaOH溶液進行尾氣處理,防止含硫化合物排放在環境中,
故答案為:液柱高度保持不變;防止倒吸;NaOH;
(2)C中Na2S和Na2SO3恰好完全反應,由Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l)(Ⅱ)
S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq)(Ⅲ)
可知,(Ⅰ)×2+(Ⅱ)+(Ⅲ)×3,得到總反應為2Na2S(aq)+Na2SO3(aq)+3SO2(g)$\frac{\underline{\;\;△\;\;}}{\;}$3Na2S2O3(aq),則C中Na2S和Na2SO3物質的量之比為2:1,
故答案為:2:1;
(3)觀察SO2的生成速率,發生強酸制取弱酸的反應,a不生成二氧化硫,bd中物質均與二氧化硫反應,只有c中飽和NaHSO3溶液適合制取二氧化硫;為使SO2緩慢進入燒瓶C,應控制B中滴加硫酸的速度,Ⅲ中發生S(g)+Na2SO3(aq)$\frac{\underline{\;\;△\;\;}}{\;}$Na2S2O3(aq),反應達到終點是S完全溶解,可觀察到溶液變澄清(或渾濁消失);燒杯、錐形瓶需要加熱時必須使用石棉網,
故答案為:c;控制滴加硫酸的速度;溶液變澄清(或渾濁消失);ad;
(4)檢測產品中是否存在Na2SO4,操作、現象和結論為取少量產品溶于足量稀鹽酸中,靜置,取上層清液(或過濾后取濾液),滴加BaCl2溶液,若出現白色沉淀則說明含有Na2SO4雜質,
故答案為:取少量產品溶于足量稀鹽酸中,靜置,取上層清液(或過濾后取濾液),滴加BaCl2溶液,若出現白色沉淀則說明含有Na2SO4雜質.
點評 本題為2014年山東高考化學試題,涉及氣密性檢驗、氧化還原反應及離子檢驗等,側重實驗分析能力及知識綜合應用能力的考查,題目難度中等,注意(2)中發生的反應及總反應的分析為易錯點.


科目:高中化學 來源: 題型:解答題
 阿伏加德羅曾經總結出一條重要定律:同溫同壓下,同體積的任何氣體含有相同數目的分子,右圖是電解水的簡易裝置.
阿伏加德羅曾經總結出一條重要定律:同溫同壓下,同體積的任何氣體含有相同數目的分子,右圖是電解水的簡易裝置.查看答案和解析>>
科目:高中化學 來源:2017屆海南省高三上學期月考三化學試卷(解析版) 題型:選擇題
某鐵的氧化物樣品,用5mol/L的鹽酸140mL恰好完 全溶解,所得溶液還能吸收0.56L氯氣(STP),使其中的Fe2+全部轉化為Fe3+。則該氧化物的化學式為( )
全溶解,所得溶液還能吸收0.56L氯氣(STP),使其中的Fe2+全部轉化為Fe3+。則該氧化物的化學式為( )
A.Fe5O7 B.Fe2O3 C.Fe3O4 D. Fe4O5
查看答案和解析>>
科目:高中化學 來源:2017屆廣西桂林十八中高三上10月月考化學試卷(解析版) 題型:選擇題
下列敘述不正確的是( )
A.鉀、鈉、鎂等活潑金屬著火時,不能用泡沫滅火器滅火
B.探究溫度對硫代硫酸鈉與硫酸反應速率的影響時,若先將兩種溶液混合并計時,再用水浴加熱至設定溫度,則測得的 反應速率偏高
反應速率偏高
C.蒸餾完畢后,應先停止加熱,待裝置冷卻后,停止通水,再拆卸蒸餾裝置
D.為準確配制一定物質的量濃度的溶液,定容過程中向容量瓶內加蒸餾水至接近刻度線時,改用滴管滴加蒸餾水至刻度線
查看答案和解析>>
科目:高中化學 來源:2017屆廣西桂林十八中高三上10月月考化學試卷(解析版) 題型:選擇題
某鐵的氧化物(FexO)1.52g溶于足量鹽酸中,向所得溶液中通入標準狀況下112mLCl2,恰好將Fe2+完全氧化。x值為( )
A.0.80 B.0.85 C.0.90 D.0.93
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
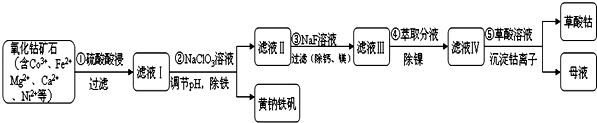
| 序號 | 礦石粒度/目 | 鈷浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com