
| 序號 | 礦石粒度/目 | 鈷浸出率/% |
| 1 | -60 | 9.8 |
| 2 | -120 | 25.5 |
| 3 | -200 | 41.18 |
 .
.
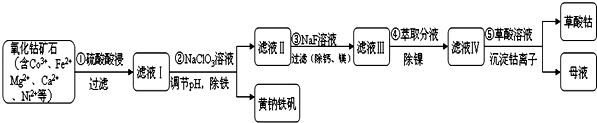
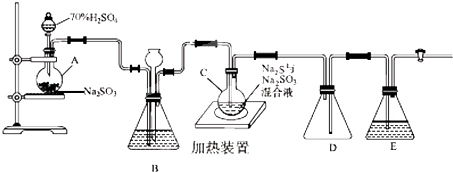
分析 氧化鈷礦石制取CoC2O4(草酸鈷),含有Co3+、Fe2+、Mg2+、Ca2+、Ni2+,黃鈉鐵礬不溶于水,可溶于酸,加入硫酸酸浸過濾得到濾液Ⅰ加入NaClO3溶液調節溶液PH除去Fe3+生成氫氧化鐵沉淀除去,過濾得到濾液Ⅱ,加入NaF除去Mg2+、Ca2+離子,過濾得到濾液Ⅲ,加入萃取劑除去Ni2+,得到濾液Ⅳ中加入草酸溶液沉淀鈷離子過濾得到草酸鈷,
(1)礦石粒度對鈷浸出率的影響可知,選擇礦石粒度應使浸出率最高;
(2)步驟①是過濾裝置,據此分析需要用到的玻璃儀器;
(3)NaClO3將Fe2+氧化成Fe3+,酸溶液中氯酸根離子被還原為氯離子,結合離子電荷守恒,原子守恒、電子守恒配平書寫化學方程式,標注電子轉移;
(4)步驟 ③中除去鎂離子的反應是氟離子和鎂離子結合生成氟化鎂沉淀;
(5)取黃鈉鐵礬用鹽酸溶液溶解,分成兩份,一份用焰色反應檢驗鈉元素的存在,另一份檢驗鐵離子的存在;
(6)母液中硫酸鈷和草酸反應生成草酸鈷沉淀和硫酸,參與反應最后又生成的物質可以循環使用.
解答 解:氧化鈷礦石制取CoC2O4(草酸鈷),含有Co3+、Fe2+、Mg2+、Ca2+、Ni2+,黃鈉鐵礬不溶于水,可溶于酸,加入硫酸酸浸過濾得到濾液Ⅰ加入NaClO3溶液調節溶液PH除去Fe3+生成氫氧化鐵沉淀除去,過濾得到濾液Ⅱ,加入NaF除去Mg2+、Ca2+離子,過濾得到濾液Ⅲ,加入萃取劑除去Ni2+,得到濾液Ⅳ中加入草酸溶液沉淀鈷離子過濾得到草酸鈷,
(1)礦石粒度對鈷浸出率的影響可知,選擇礦石粒度應使浸出率最高,礦石粒度為-200目,鈷浸出率41.18%,浸出率最高,
故答案為:-200;
(2)步驟①是過濾裝置,據此分析需要用到的玻璃儀器,用到的玻璃儀器,除燒杯外還有漏斗、玻璃棒,
故答案為:漏斗、玻璃棒;
(3)NaClO3將Fe2+氧化成Fe3+,酸溶液中氯酸根離子被還原為氯離子,結合離子電荷守恒,原子守恒、電子守恒配平書寫化學方程式,標注電子轉移,得到的離子方程式為: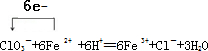 ,
,
故答案為: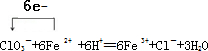 ;
;
(4)步驟 ③中除去鎂離子的反應是氟離子和鎂離子結合生成氟化鎂沉淀,反應的離子方程式為:Mg2++2F-=MgF2↓,
故答案為:Mg2++2F-=MgF2↓;
(5)取黃鈉鐵礬用鹽酸溶液溶解,分成兩份,一份用焰色反應檢 驗鈉元素的存在,另一份檢驗鐵離子的存在,實驗設計為:取黃鈉鐵礬用鹽酸溶液溶解,分成兩份,一份做火焰色反應,火焰為黃色證明有Na+存在;另一份向其中滴加KSCN溶液,溶液變成血紅色,證明有Fe3+存在,
故答案為:取黃鈉鐵礬用鹽酸溶液溶解,分成兩份,一份做火焰色反應,火焰為黃色證明有Na+存在;另一份向其中滴加KSCN溶液,溶液變成血紅色,證明有Fe3+存在;
(6)母液中硫酸鈷和草酸反應生成草酸鈷沉淀和硫酸,參與反應最后又生成的物質可以循環使用,硫酸可以循環使用,
故答案為:硫酸.
點評 本題考查了物質分離提純,物質性質和實驗分離方法、流程的分析應用,主要是物質性質的理解應用,掌握基礎是解題關鍵,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇.化工行業的發展必須符合國家節能減排的總體要求.試運用所學知識,解決下列問題:
實施以減少能源浪費和降低廢氣排放為基本內容的節能減排政策,是應對全球氣候問題、建設資源節約型、環境友好型社會的必然選擇.化工行業的發展必須符合國家節能減排的總體要求.試運用所學知識,解決下列問題: CO(g)+H2(g)△H=+132kJ/mol
CO(g)+H2(g)△H=+132kJ/mol| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗序號 |  | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 500 | 2.0 | 1.6 | 1.3 | 1.0 | 0.8 | 0.8 |
| 2 | 500 | C2 | 1.2 | 0.8 | 0.8 | 0.8 | 0.8 |
| 3 | 500 | C3 | 1.7 | 1.3 | 1.0 | 1.0 | 1.0 |
| 4 | 600 | 2.0 | 1.1 | 0.9 | 0.9 | 0.9 | 0.9 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3:2:2 | B. | 1:2:3 | C. | 1:3:3 | D. | 3:1:1 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com