
分析 n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,銅與濃硝酸反應生成NO2,隨著反應的進行,硝酸的濃度逐漸降低,稀硝酸與銅反應生成NO,NO2、NO的物質的量共為:$\frac{13.44L}{22.4L/mol}$=0.6mol,
(1)設混合氣體中含有NOxmol,則含有二氧化氮為(0.6-x)mol,根據電子守恒計算出NO的物質的量,最高價V=nVm計算出標準狀況下NO體積;
(2)被還原的硝酸的物質的量等于生成NO2、NO的總的物質的量;
(3)n(Cu)=0.5mol,反應后生成Cu(NO3)2、NO和NO2,且NO和NO2的物質的量總共為0.6mol,據此可計算出硝酸的總物質的量,然后根據c=$\frac{n}{V}$計算出該硝酸的物質的量濃度;
(4)若要使水恰好充滿容器,則NO2、NO與氧氣和水完全反應生成硝酸,根據電子守恒可知硝酸與銅反應得到電子的物質的量應等于O2氧化NO2、NO生成硝酸得到電子的物質的量,也等于0.5molCu失去電子的物質的量,根據關系式2Cu~O2計算出氧氣的體積.
解答 解:n(Cu)=$\frac{32g}{64g/mol}$=0.5mol,銅與濃硝酸反應生成NO2,隨著反應的進行,硝酸的濃度逐漸降低,稀硝酸與銅反應生成NO,NO2、NO的物質的量共為:$\frac{13.44L}{22.4L/mol}$=0.6mol,
(1)設混合氣體中含有NOxmol,則含有二氧化氮為(0.6-x)mol,根據電子守恒可得:0.5mol×2=(5-2)x+(0.6-x)×(5-4),解得:x=0.2mol,
標準狀況下0.2molNO氣體的體積為:22.4L/mol×0.2mol=4.48L,
答:生成NO氣體在標準狀況下的體積為4.48L;
(2)NO2、NO的物質的量共0.6mol,被還原的硝酸的物質的量等于生成NO2、NO的總的物質的量,為0.2mol,
答:被還原的HNO3的物質的量為0.6mol;
(3)n(Cu)=0.5mol,反應后生成Cu(NO3)2、NO和NO2,且NO和NO2的物質的量總共為0.6mol,則反應中消耗HNO3的物質的量為:2n(Cu(NO3)2)+n(NO)+n(NO2)=2×0.5mol+0.6mol=1.6mol,
所以原硝酸的物質的量濃度為:$\frac{1.6mol}{0.1L}$=16mol/L,
答:原硝酸的物質的量濃度16mol/L;
(4)將收集上述氣體的容器倒扣在盛有水的水槽中,并向其中緩慢通入O2,使其充分反應,若要使水恰好充滿容器,則NO2、NO與氧氣和水完全反應生成硝酸,根據電子守恒可知硝酸與銅反應得到電子的物質的量應等于O2氧化NO2、NO生成硝酸得到電子的物質的量,也等于0.5molCu失去電子的物質的量,
設需通入O2的體積為x,由電子守恒,可得:
2Cu~O2
2mol 22.4L
0.5mol x
2mol:22.4L=0.5mol:x
解得:x=5.6L,
答:理論上需要通入O2的在標準狀況的體積是5.6L.
點評 本題考查氧化還原反應的計算,題目難度中等,注意把握硝酸的性質,解答本題的關鍵是把握氧化還原反應的特點:氧化劑和還原劑得失電子數目相等,(4)為易錯點,答題時注意從守恒的角度入手思考.


科目:高中化學 來源: 題型:選擇題
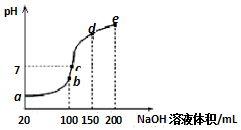 常溫下,現向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH與NaOH溶液體積的關系曲線如圖所示(假設滴加過程中無氣體產生).下列說法正確的是( )
常溫下,現向50mL 0.1mol•L-1 NH4HSO4溶液中滴加0.05mol•L-1 NaOH溶液,得到溶液的pH與NaOH溶液體積的關系曲線如圖所示(假設滴加過程中無氣體產生).下列說法正確的是( )| A. | b點溶液中離子濃度由大到小的順序為:c(Na+)>c(SO42-)>c(NH4+)>c(H+)>c(OH-) | |
| B. | 圖中b、c、d、三點溶液中水的電離程度最大的是c點 | |
| C. | b點后滴加NaOH溶液過程中,NH3•H2O的電離程度逐漸減小 | |
| D. | pH=7時,溶液中c(H+)+c(Na+)+c(NH4+)=c(SO42-)+c(OH-) |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該反應中還原劑是C,還原產物有兩種 | |
| B. | 若有32g硫參加反應,則被硫氧化的碳單質物質的量為3mol | |
| C. | 若在標準狀況下生成8.96L氣體,則轉移的電子數為1.2NA | |
| D. | 產物中的兩種氣體在一定條件下都能夠和Mg發生反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①④⑤ | B. | ①②⑤ | C. | ②③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氫氧化鈉溶液中通入過量CO2:CO2+2OH-═CO${\;}_{3}^{2-}$+H2O | |
| B. | 向澄清石灰水中通入過量CO2;Ca2++2OH-+CO2=CaCO3↓++H2O | |
| C. | 硫酸氫鈉溶液中加入過量氫氧化鋇溶液:2HSO${\;}_{4}^{-}$+2Ba2++2OH-=2BaSO4↓+2H2O | |
| D. | 向碳酸氫鈣溶液中加入過量石灰水:Ca2++OH-+HCO${\;}_{3}^{-}$=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 硅膠可防止食物受潮是由于其具有吸水性 | |
| B. | 葡萄糖用于醫療輸液是因為它屬于強電解質 | |
| C. | Na2CO3可用作食用堿,因為Na2CO3的水溶液顯堿性 | |
| D. | 酸性重鉻酸鉀用于檢查酒駕是利用其強氧化性 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com