
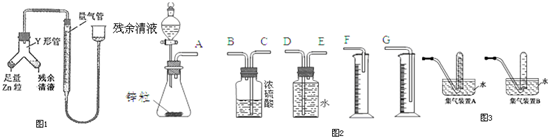
分析 (1)根據稱量生成的BaSO4質量可求出硫酸根離子的量,但沒有溶液的體積;
(2)①用液壓法檢驗裝置氣密性,連接裝置后,向量氣管右端注水,直到左右兩邊管子形成一段液面差,一段時間后液面差不變;
②將固體加入液體中,Zn粒與銅離子反應生成銅單質,并且生成氣體,實驗現象是表面析出暗紅色固體,有大量氣泡,鋅粒部分溶解;
③此反應為放熱反應,氣體受熱膨脹,未冷卻;
(3)①測量氫氣的體積,量筒內導管應伸入量筒底部,否則,壓入的水可能會粘到量筒壁上,導致誤差,所以最簡易的裝置其連接順序EDG;
②鋅與殘余清液中硫酸銅反應生成銅,銅鋅形成原池,使鋅與硫酸反應速率加快,反應生成大量氣體且放熱,導致錐形瓶內壓強增大;
③根據題意可知,氫氣的體積為(b-a)mL,1mol硫酸能生成1mol氫氣,所以殘余清液中硫酸的物質的量為$\frac{(b-a)×1{0}^{-3}}{22.4}$mol,根據c=$\frac{n}{V}$求出硫酸的物質的量濃度;
④氫氣密度比空氣小,用排水法收集氫氣,應短進.
解答 解:(1)沒有溶液的體積,加入足量的BaCl2溶液只能求出硫酸根離子的量,而不能求出剩余硫酸的濃度;
故答案為:加入足量的BaCl2溶液只能求出硫酸根離子的量,而不能求出剩余硫酸的濃度;
(2)①用液壓法檢驗裝置氣密性,連接裝置后,向量氣管右端注水,直到左右兩邊管子形成一段液面差,一段時間后液面差不變
故答案為:連接裝置后,向量氣管右端注水,直到左右兩邊管子形成一段液面差,一段時間后液面差不變;
②將固體加入液體中,Zn粒與銅離子反應生成銅單質,并且生成氣體,實驗現象是表面析出暗紅色固體,有大量氣泡,鋅粒部分溶解
故答案為:Zn粒;稀硫酸;表面析出暗紅色固體,有大量氣泡,鋅粒部分溶解;
③此反應為放熱反應,氣體受熱膨脹,未冷卻;
故答案為:該反應放熱,氣體未冷卻;
(3)①測量氫氣的體積,最簡易的裝置其連接順序EDG;
故答案為:E;D;G;
②鋅與殘余清液中硫酸銅反應生成銅,銅鋅形成原池,使鋅與硫酸反應速率加快,反應生成大量氣體且放熱,導致錐形瓶內壓強增大
故答案為:鋅與殘余清液中硫酸銅反應生成銅,銅鋅形成原池,使鋅與硫酸反應速率加快,反應生成大量氣體且放熱,導致錐形瓶內壓強增大;
③根據題意可知,氫氣的體積為(b-a)mL,1mol硫酸能生成1mol氫氣,所以殘余清液中硫酸的物質的量為$\frac{(b-a)×1{0}^{-3}}{22.4}$mol,其物質的量濃度c=$\frac{n}{V}$=$\frac{\frac{(b-a)×1{0}^{-3}}{22.4}}{a×1{0}^{-3}}$mol/L=$\frac{b-a}{22.4a}$mol/L;
故答案為:$\frac{b-a}{22.4a}$mol/L;
④氫氣密度比空氣小,用排水法收集氫氣,應短進,
故答案為:B.
點評 本題考查了主要過量的銅與濃硫酸反應后溶液中硫酸濃度的測定,涉及裝置的分析,實驗現象分析和化學計算,題目難度中等,注意物質性質的掌握.


科目:高中化學 來源: 題型:選擇題
| A. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{3}{2}$ | B. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<$\frac{1}{2}$ | C. | $\frac{1}{4}$<$\frac{n(X)}{n(Y)}$<4 | D. | $\frac{1}{2}$<$\frac{n(X)}{n(Y)}$<4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 某校化學課外活動小組設計如下圖實驗裝置,完成探究某些物質的性質和比較性質強弱的實驗.
某校化學課外活動小組設計如下圖實驗裝置,完成探究某些物質的性質和比較性質強弱的實驗.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 .乙烯的電子式是
.乙烯的電子式是 .將6.72L(標準狀況)乙烯和甲烷的混合氣通入足量的溴水中,充分反應后,溴水的質量增加了1.4g,原混合氣體中乙烯和甲烷的物質的量之比是1:5
.將6.72L(標準狀況)乙烯和甲烷的混合氣通入足量的溴水中,充分反應后,溴水的質量增加了1.4g,原混合氣體中乙烯和甲烷的物質的量之比是1:5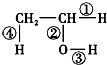 在不同的化學反應中會斷裂不同的化學鍵,請寫出下列反應的化學方程式,并指出反應時乙醇分子中斷裂的化學鍵.
在不同的化學反應中會斷裂不同的化學鍵,請寫出下列反應的化學方程式,并指出反應時乙醇分子中斷裂的化學鍵.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 436kJ | B. | 557kJ | C. | 872kJ | D. | 181kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液中一定不含Ba2+ | |
| B. | 該溶液中一定含Na+ | |
| C. | 無色氣體在標準狀況下的體積約為2.24L | |
| D. | 若向該溶液中加入足量NaOH溶液,濾出沉淀,洗凈灼燒后最多能得8.0g固體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示,錐形瓶中盛有氣體X,滴管內盛有液體Y,若擠壓滴管膠頭,使液體Y滴入瓶中,震蕩,過一會兒可見小氣球a鼓起.氣體X和液體Y不可能是( )
如圖所示,錐形瓶中盛有氣體X,滴管內盛有液體Y,若擠壓滴管膠頭,使液體Y滴入瓶中,震蕩,過一會兒可見小氣球a鼓起.氣體X和液體Y不可能是( )| A. | X是NH3,Y是水 | B. | X是CO2,Y是飽和NaHCO3濃溶液 | ||
| C. | X是SO2,Y是NaOH溶液 | D. | X是HCl,Y是NaNO3稀溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com