

 .
. 分析 由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)電子層越多半徑越大,電子層相同時核電荷數越大半徑越小;
(2)非金屬性越強,氫化物越穩定;
(3)N元素的氣態氫化物和該元素的最高價氧化物的水化物能發生化合反應,生成硝酸銨;
(4)①、⑧兩種元素組成的化合物為HCl,為共價化合物;
(5)⑥的單質與①、④、⑤三種元素形成化合物的水溶液反應,生成偏鋁酸鈉和氫氣.
解答 解:由元素在周期表中的位置可知,①是H,②是C,③是N,④是O,⑤是Na,⑥是Al,⑦是Si,⑧是Cl,
(1)電子層越多半徑越大,所以Na、Al>O,電子層一樣多的原子,核電荷數越多半徑越小,即Na>Al,故答案為:Na>Al>O;
(2)非金屬性O>N>C,則氫化物穩定性由強到弱的順序是H2O>NH3>CH4,故答案為:H2O>NH3>CH4;
(3)N元素的氣態氫化物和該元素的最高價氧化物的水化物能發生化合反應,生成硝酸銨,化學式為NH4NO3,故答案為:NH4NO3;
(4)①、⑧兩種元素組成的化合物為HCl,為共價化合物,其電子式為 ,故答案為:
,故答案為: ;
;
(5)⑥的單質與①、④、⑤三種元素形成化合物的水溶液反應,生成偏鋁酸鈉和氫氣,離子反應為2Al+2H2O+2OH-=2AlO2-+3H2↑,
故答案為:2Al+2H2O+2OH-=2AlO2-+3H2↑.
點評 本題考查位置、結構與性質的關系,為高頻考點,把握元素的位置、元素化合物性質為解答的關鍵,側重分析與應用能力的考查,題目難度不大.


科目:高中化學 來源: 題型:選擇題
| A. | 140 mL | B. | 120 mL | C. | 100 mL | D. | 80 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨基酸、多肽、蛋白質都具有兩性 | |
| B. | 利用油脂在酸性條件下水解,可以產生甘油和肥皂 | |
| C. | 淀粉與纖維素分子式都為(C6H10O5)n,但結構不同,所以它們互為同分異構體 | |
| D. | 飽和Na2SO4、CuSO4溶液均可用于蛋白質的鹽析 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.1 s | B. | 2.5 s | C. | 10 s | D. | 5 s |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
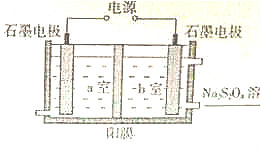
 利用如圖裝置可驗證酸的強弱規律.
利用如圖裝置可驗證酸的強弱規律.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3≤原子最外層電子數<8的元素一定是非金屬元素 | |
| B. | 原子最外層只有1個電子的元素一定是第ⅠA族元素 | |
| C. | 最外層電子數比次外層電子數多的元素一定是第2周期元素 | |
| D. | 某元素的離子最外層電子數與次外層電子數相同,該元素一定位于第3周期 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C2H6 | B. | C4H10 | C. | C5H8 | D. | C7H8 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com