
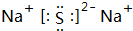 .
.分析 W、X、Y、Z是原子序數依次增大的同一短同期元素,W、X是金屬元素,其最高價氧化物對應的水化物為堿,且兩種堿可以反應生成鹽和水,則W為Na元素,X為Al元素;Y、Z是非金屬元素,W為Na,W可以和Y形成W2Y,則Y為-2價,為ⅥA元素,且和鈉同周期,所以Y為S,Y的低價氧化物為SO2;Z原子序數比Y大,所以Y為Cl,據此解答.
解答 解:W、X、Y、Z是原子序數依次增大的同一短同期元素,W、X是金屬元素,其最高價氧化物對應的水化物為堿,且兩種堿可以反應生成鹽和水,則W為Na元素,X為Al元素;Y、Z是非金屬元素,W為Na,W可以和Y形成W2Y,則Y為-2價,為ⅥA元素,且和鈉同周期,所以Y為S,Y的低價氧化物為SO2;Z原子序數比Y大,所以Y為Cl.
(1)Y的硝酸鹽為Al(NO3)3,由于Al3+的水解:Al3++3H2O?Al(OH)3+3H+,其溶液呈酸性,
故答案為:酸;Al3++3H2O?Al(OH)3+3H+;
(2)NaOH和Al(OH)3反應的離子方程式:Al(OH)3+OH-=AlO2-+2H2O,
故答案為:Al(OH)3+OH-=AlO2-+2H2O;
(3)Y的低價氧化物為SO2,并且Z和Y同周期,原子序數比Y大,所以Z為Cl,Y的低價氧化物和Z的單質反應方程式:SO2+Cl2+2H2O=H2SO4+2HCl,故答案為:SO2+Cl2+2H2O=H2SO4+2HCl;
(4)W2Y為Na2S,屬于離子化合物,電子式為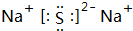 ,故答案為:
,故答案為: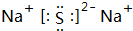 ;
;
(5)非金屬性越強,氣態氫化物的穩定性越強,由于非金屬性:Cl>S,所以氣態氫化物的穩定性:H2S<HCl,故答案為:H2S<HCl;
(6)核外電子排布相同的離子,核電荷數越大,離子半徑越小,且離子核外電子層數越多,離子半徑越大,則有離子半徑Al3+<Na+<Cl-<S2-,
故答案為:Al3+<Na+<Cl-<S2-,
(7)Z的最高價氧化物為是Cl2O7,Cl2O7和水反應生成高氯酸,0.25molCl2O7和水反應放出QkJ熱量,則1molCl2O7和水反應放出4QkJ熱量,所以其熱化學反應方程式為:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol,
故答案為:Cl2O7(l)+H2O(l)=2HClO4(aq)△H=-4QkJ/mol.
點評 本題考查結構性質位置關系應用,關鍵是對元素周期律的理解掌握,難度中等.


科目:高中化學 來源: 題型:解答題
 .
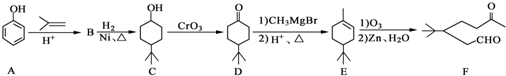
. .同時滿足下列條件的B的同分異構體(不包括B)共有11種:能與FeCl3溶液顯紫色,苯環上只有兩個取代基.
.同時滿足下列條件的B的同分異構體(不包括B)共有11種:能與FeCl3溶液顯紫色,苯環上只有兩個取代基. (任寫一種).
(任寫一種).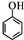 )和CH2=CH2為原料制備有機物
)和CH2=CH2為原料制備有機物  的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:
的合成路線流程圖(無機試劑任用).合成路線流程圖示例如下:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 原電池的總反應為Fe+Cu2+═Fe2++Cu | |
| B. | 鹽橋中是KNO3溶液,則鹽橋中NO3-移向乙燒杯 | |
| C. | 其他條件不變,若將CuCl2溶液換為NH4Cl溶液,石墨電極反應式為2H++2e-═H2↑ | |
| D. | 反應前,電極質量相等,一段時間后,兩電極質量相差12g,導線中通過0.2mol電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;元素Z的離子結構示意圖為
;元素Z的離子結構示意圖為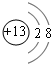 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 看反應前后是否有氧原子的得失 | |
| B. | 看反應前后是否有原子的重新組合 | |
| C. | 看反應前后是否有元素的化合價發生改變 | |
| D. | 看反應后是否有氣體生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
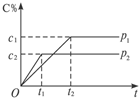 在一定溫度下的可逆反應:mA(g)+nB(g)?pC(g)+qD(g),生成物C的體積分數與壓強p1和p2,時間t1和t2的關系如圖所示,則在下列關系中正確的是( )
在一定溫度下的可逆反應:mA(g)+nB(g)?pC(g)+qD(g),生成物C的體積分數與壓強p1和p2,時間t1和t2的關系如圖所示,則在下列關系中正確的是( )| A. | p1>p2 | B. | 反應吸熱 | C. | m+n>p+q | D. | m+n<p+q |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com