
分析 溶液中發生反應為Fe+2H+=Fe2++H2↑,根據n=$\frac{V}{{V}_{m}}$計算氫氣的物質的量,利用離子方程式計算生成的Fe的物質的量;和鹽酸的物質的量,由此分析解答.
解答 解:標準狀況下4.48L氫氣的物質的量為$\frac{4.48L}{22.4L/mol}$=0.2mol,則:
Fe+2H+=Fe2++H2↑,
1mol 2mol 1mol
n(Fe) n(HCl) 0.2mol
所以$\frac{1}{n(Fe)}=\frac{2}{n(HCl)}=\frac{1}{0.2mol}$,
解之得:n(Fe)=0.2mol,n(HCl)=0.4mol,
則:則至少需要鹽酸的體積為$\frac{0.4mol}{0.5mol/L}$=0.8L,消耗鐵的質量為0.2×56=11.2g,答:需要鹽酸的體積為0.8L,消耗鐵的質量為11.2g.
點評 本題考查根據方程式的有關計算,比較基礎,注意基礎知識的理解掌握.


 陽光課堂課時作業系列答案
陽光課堂課時作業系列答案科目:高中化學 來源: 題型:實驗題
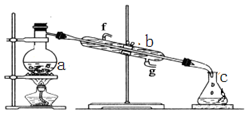
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
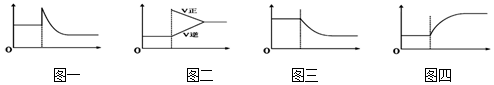
| A. | 可逆反應:Cr2O72-(橙色)+H2O?2CrO42-(黃色)+2H+達平衡狀態溶液呈橙黃色,滴加少量的濃硫酸,溶液變橙色,氫離子濃度隨時間變化曲線如圖一 | |
| B. | 可逆反應Co(H2O)62+(粉紅色)+4Cl-?CoCl42- (藍色)+6H2O達平衡狀態溶液呈紫色,升高溫度,溶液變藍色,反應速率隨時間變化曲線如圖二 | |
| C. | 可逆反應:2NO2?N2O4達平衡狀態呈紅棕色,加壓紅棕色變深,NO2物質的量隨時間變化曲線如圖三 | |
| D. | 可逆反應:N2(g)+3H2(g)?2NH3(g)△H<0達平衡狀態,升高溫度,NH3體積分數隨時間變化曲線如圖四 |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題

| 物質 | 熔點/℃ | 沸點/℃ | 密度/g•cm-3 | 溶解性 |
| A | -11.5 | 198 | 1.11 | A、B互溶,且均易溶于水和酒精 |
| B | 17.9 | 290 | 1.26 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ${\;}_{20}^{40}$Ca和${\;}_{18}^{40}$Ar | B. | 16O和18O | ||
| C. | H2O和H2O2 | D. | O3和O2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | HCl、HBr、HI、HF的沸點依次升高 | |
| B. | 氨分子中N-H鍵的極性小于水分子中O-H鍵的極性 | |
| C. | 乙醇分子間存在氫鍵,乙醛分子間不存在氫鍵,故乙醇的沸點高于乙醛 | |
| D. | 由于N-H鍵強于P-H鍵,故NH3的沸點高于PH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無法比較 | B. | Q1<Q2 | C. | Q1=Q2 | D. | Q1>Q2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com