
| A. | 明礬溶液中加入過量的氨水:Al3++4OH-═AlO2-+2H2O | |
| B. | 銅粉與98.3%的硫酸加熱下反應 Cu+4H++SO42-$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O | |
| C. | 氯化亞鐵溶液中加入硝酸:3Fe2++4H++NO3-═3Fe3++2H2O+NO↑ | |
| D. | 澄清石灰水中加入少量的NaHCO3溶液:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32- |
分析 A.注意氫氧化鋁不溶于弱堿的性質;
B.濃硫酸應寫成化學式;
C.亞鐵離子與硝酸發生氧化還原反應生成鐵離子、NO和水;
D.澄清石灰水中加入少量的NaHCO3溶液,生成碳酸鈣和水.
解答 解:A.明礬溶液中加入過量的氨水反應生成氫氧化鋁,氫氧化鋁與氨水不反應,離子方程式為Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故A錯誤;
B.銅粉與98.3%的硫酸加熱下反應的離子方程式為2H2SO4(濃)+Cu$\frac{\underline{\;\;△\;\;}}{\;}$Cu2++SO2↑+2H2O+SO42-,故B錯誤;
C.亞鐵離子與硝酸發生氧化還原反應生成鐵離子、NO和水,反應的離子方程式為3Fe2++4H++NO3-═3Fe3++2H2O+NO↑,故C正確;
D.澄清石灰水中加入少量的NaHCO3溶液,生成碳酸鈣和水,反應的離子方程式為Ca2++OH-+HCO3-═CaCO3↓+H2O,故D錯誤.
故選C.
點評 本題考查了離子方程式的正誤判斷,為中等難度的試題,注意明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合守恒關系(如:質量守恒和電荷守恒等)、檢查是否符合原化學方程式等.


科目:高中化學 來源: 題型:選擇題
| A. | 其他條件不變,改變反應物的量,△H發生改變 | |
| B. | 上述反應生成1mol SO3,放熱少于98.5KJ | |
| C. | 相同條件下加入2molSO2(g)、1mol O2(g) 充分反應放熱等于197KJ | |
| D. | 相同條件下加入1molSO2(g)、0.5mol O2(g) 充分反應放熱為Q1 kJ,若在相同容器中加入1mol SO3充分反應吸熱等于Q2kJ,Q1kJ+Q2 kJ=98.5kJ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 苯酚鈉溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- | |
| B. | FeSO4的酸性溶液中加H2O2:2Fe2++H2O2+2H+═2Fe3++2H2O | |
| C. | 用氨水吸收少量的SO2:NH3•H2O+SO2═NH4++HSO3- | |
| D. | 碳酸氫鈉溶液中加入過量石灰水:HCO3-+OH-═CO32-+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
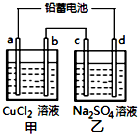 用鉛蓄電池電解甲、乙電解池中的溶液.已知鉛蓄電池的總反應為:
用鉛蓄電池電解甲、乙電解池中的溶液.已知鉛蓄電池的總反應為:| A. | d極為陰極 | |
| B. | 放電時鉛蓄電池負極的電極反應式為:PbO2(s)+4H+(aq)+SO42-(aq)+4e-═PbSO4(s)+2H2O(l) | |
| C. | 若利用甲池精煉銅,b極應為粗銅 | |
| D. | 若四個電極材料均為石墨,當析出6.4gCu時,兩池中共產生氣體3.36L(標準狀況下) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溶質 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
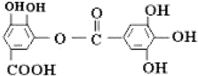
| A. | 常溫下,能與NaHCO3溶液反應放出CO2 | |
| B. | 該有機物的分子式為C14H10O9 | |
| C. | 與稀H2SO4共熱,生成2種有機物 | |
| D. | 能發生堿性水解反應,1mol該有機物完全反應消耗掉8molNaOH |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com