
分析 (1)電解質:在水溶液中或熔融狀態下能夠導電的化合物;
非電解質:在熔融狀態和水溶液中都不能導電的化合物;
(2)離子方程式為:H++OH-═H2O,可表示強酸與強堿反應生成可溶性鹽和水的離子反應;
(3)根據碳酸鈉加熱不分解,碳酸氫鈉加熱分解得到碳酸鈉、水、二氧化碳來解答;
(4)根據n=$\frac{V}{Vm}$結合分子的構成計算.
(5)根據n=$\frac{m}{M}$計算Fe3+的物質的量,溶液中2n(SO42-)=3n(Fe3+),再根據c=$\frac{n}{V}$計算SO42-的物質的量濃度;
(6)膠體加入電解質會發生聚沉;
(7)電解質溶液導電能力強弱取決于離子濃度的大小,氨水中加入鹽酸依據反應物和生成物的性質判斷離子濃度的變化進而判斷導電能力變化;
解答 解:(1)①液態氯化氫在水溶液中能導電,是電解質;
②NaHCO3在水溶液或者熔融狀態下能夠導電,是電解質;
③固體純堿在水溶液或者熔融狀態下能夠導電,是電解質;
④葡萄糖在水溶液和熔融狀態下都不能夠導電,是非電解質;
⑤Ba(OH)2在熔融狀態下能導電,是電解質;
⑥氫氧化鉀在水溶液或者熔融狀態下能夠導電,是電解質;
⑦氫氧化鐵膠體屬于混合物 既不是電解質也不是非電解質;
⑧氨水屬于混合物 既不是電解質也不是非電解質;
⑨空氣屬于混合物 既不是電解質也不是非電解質;
⑩硫酸鐵溶液屬于混合物 既不是電解質也不是非電解質;
故屬于電解質的是:①②③⑥,非電解質的有:④⑤;
故答案為:①②③⑥;④⑤;
(2)離子方程式為:H++OH-═H2O,可表示強酸與強堿反應生成可溶性鹽和水的離子反應,如HCl+KOH=H2O+KCl;
故答案為:HCl+KOH=H2O+KCl;
(3)根據碳酸鈉加熱不分解,碳酸氫鈉加熱分解得到碳酸鈉、水、二氧化碳,所以除去固體純堿中少量小蘇打的操作是加熱,方程式為:
故答案為:加熱;2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑;
(4)n(CO2)=$\frac{1}{2}$n(O)=0.2mol,V(CO2)=0.2mol×22.4L/mol=4.48L;
故答案為:4.48;
(5)Fe3+的物質的量為$\frac{5.6g}{56g/mol}$=0.1mol,溶液中2n(SO42-)=3n(Fe3+),則SO42-的物質的量為0.1mol×$\frac{3}{2}$=0.15mol,SO42-的物質的量濃度為$\frac{0.15mol}{0.1L}$=1.5mol/L;
故答案為:1.5mol/L;
(6)若在氫氧化鐵膠體中緩慢加入氫氧化鉀,膠體發生聚沉,產生的現象是產生紅褐色沉淀;
故答案為:產生紅褐色沉淀;
(7)氨水中的一水合氨是弱電解質,部分電離產生出自由移動的離子濃度較小,加入鹽酸后反應生成氯化銨是強電解質,完全電離,所以離子濃度逐漸增大,導電能力逐漸增強,
故答案為:增強;
點評 本題考查了物質導電的條件,電解質和非電解質的概念,膠體的性質,離子方程式書寫,物質的量有關計算等,題目綜合性強,氫氧化鐵膠體性質的考查是本題的難點,題目難度中等.


 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 在如圖所示的電解質溶液的導電性裝置中,若向某-電解質溶液中逐滴加入另一種溶液時.則燈光由亮變暗至熄滅后又逐漸變亮的是( )
在如圖所示的電解質溶液的導電性裝置中,若向某-電解質溶液中逐滴加入另一種溶液時.則燈光由亮變暗至熄滅后又逐漸變亮的是( )| A. | 鹽酸中逐滴加入食鹽溶液 | B. | 醋酸中逐滴加入氫氧化鈉溶液 | ||
| C. | 氫氧化鋇溶液中逐滴加入硫酸溶液 | D. | 醋酸中逐滴加入氨水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 化學鍵 | C-H | C-C | C═C | H-H |
| 鍵能/kJ•mol-1 | 412 | 348 | 612 | 436 |
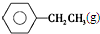 $\stackrel{催化劑}{?}$
$\stackrel{催化劑}{?}$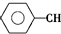 ≡CH2(g)+H2(g)的反應熱△H為( )
≡CH2(g)+H2(g)的反應熱△H為( )| A. | -124 kJ/mol | B. | +124 kJ/mol | C. | -40 kJ/mol | D. | +40 kJ/mol |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用小蘇打(NaHCO3)發酵面團制作饅頭 | |
| B. | 干燥的氯氣和液氯均能使干燥的有色布條褪色 | |
| C. | 用Al(OH)3治療胃酸過多 | |
| D. | 光導纖維的主要成分是SiO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu是氧化劑 | B. | HNO3在反應中被氧化 | ||
| C. | 每生成1 mol NO轉移3 mol e- | D. | HNO3僅表現出酸性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、H+、SO42-、OH- | B. | Na+、Ca2+、CO32-、NO3- | ||
| C. | Na+、H+、Fe2+、NO3- | D. | Na+、Cu2+、Cl-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com