
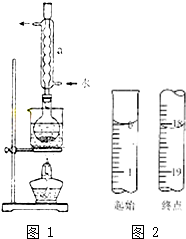
 Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.
Na2S2O3是重要的化工原料,易溶于水.在中性或堿性環境中穩定.分析 (1)硫粉難溶于水、微溶于乙醇,乙醇濕潤可以使硫粉易于分散到溶液中;
(2)根據儀器結構特征寫出其名稱,冷凝管起到冷凝回流的作用;
(3)由于Na2S2O3、Na2SO3具有還原性,易被氧氣氧化Na2SO4,檢驗溶液是否硫酸根離子進行判斷;
(4)S2O32-與氫離子在溶液中能夠發生氧化還原反應生成硫單質與二氧化硫;
(5)滴定前溶液為無色,滴定結束后,碘單質使淀粉變藍;
(6)根據圖示的滴定管中液面讀出初讀數、終讀數,然后計算出消耗碘的標準溶液體積;
進行過量計算,根據不足量的物質計算理論產量,根據反應2S2O32-+I2═S4O62-+2I-,可知n(S2O32-)=2n(I2),進而計算樣品的產率;
(7)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,反應生成硫酸鈉、氯化鈉,配平書寫離子方程式.
解答 解:(1)硫粉難溶于水微溶于乙醇,所以硫粉在反應前用乙醇濕潤是使硫粉易于分散到溶液中,
故答案為:使硫粉易于分散到溶液中;
(2)根據圖示中儀器的結構特征,可知儀器a為冷凝管,該實驗中冷凝管具有冷凝回流的作用,
故答案為:冷凝管;冷凝回流;
(3)由于Na2S2O3、Na2SO3具有還原性,易被氧氣氧化Na2SO4,所以可能存在的雜質是Na2SO4;檢驗硫酸鈉的方法為:取少量產品溶于過量稀鹽酸,過濾,向濾液中加BaCl2溶液,若有白色沉淀,則產品中含有Na2SO4,
故答案為:Na2SO4; 取少量產品溶于過量稀鹽酸,過濾,向濾液中加BaCl2溶液,若有白色沉淀,則產品中含有Na2SO4;
(4)S2O32?與氫離子發生氧化還原反應生成淡黃色硫單質,反應的離子方程式為:S2O32?+2H+=S↓+SO2↑+H2O,
故答案為:S2O32?+2H+=S↓+SO2↑+H2O;
(5)滴定結束后,碘單質使淀粉變藍,所以滴定終點時溶液顏色變化為:由無色變為藍色,
故答案為:由無色變為藍色;
(6)根據圖示的滴定管中液面可知,滴定管中初始讀數為0,滴定終點液面讀數為18.10mL,所以消耗碘的標準溶液體積為18.10mL;
根據反應2S2O32-+I2═S4O62-+2I-可知,n(S2O32-)=2n(I2),所以W g產品中含有Na2S2O3•5H2O質量為:0.1000 mol•L-1×18.10×10-3L×2×M=3.620×10-3Mg,則產品的純度為:$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%=$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%,
故答案為:18.10;$\frac{3.620×1{0}^{-3}Mg}{Wg}$×100%;
(7)Na2S2O3還原性較強,在溶液中易被Cl2氧化成SO42-,配平后的離子方程式為:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+,
故答案為:S2O32?+4Cl2+5H2O=2SO42?+8Cl?+10H+.
點評 本題考查化學實驗制備,涉及儀器識別、離子的檢驗方法、對裝置分析評價、氧化還原反應滴定與計算、離子方程式書寫等,是對學生綜合能力的考查,難度中等.


 暑假銜接教材期末暑假預習武漢出版社系列答案
暑假銜接教材期末暑假預習武漢出版社系列答案 假期作業暑假成長樂園新疆青少年出版社系列答案
假期作業暑假成長樂園新疆青少年出版社系列答案科目:高中化學 來源: 題型:多選題
| A. | 瓦斯中甲烷和氧氣的質量比為1:4時極易爆炸,此時甲烷與氧氣的體積比為1:2 | |
| B. | 欲配制1.00 L1.00 mol•L-1的NaCl溶液,可將58.5 g NaCl溶于1.00 L水中 | |
| C. | 22.4LN2和H2的混合氣體中含NA個原子 | |
| D. | 3mol單質Fe完全轉變為Fe3O4,得到8NA個電子 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 實驗編號 | NaOH溶液的濃度(mol•L-1) | 滴定完成時,NaOH溶液滴入的體積(mL) | 待測鹽酸的體積(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 用已知濃度的NaOH溶液測定某H2SO4溶液的濃度,參考如圖,從下表中選出
用已知濃度的NaOH溶液測定某H2SO4溶液的濃度,參考如圖,從下表中選出| 錐形瓶中的液 | 滴定管中的溶液 | 選用指示劑 | 選用滴定管 | |
| ① | 堿 | 酸 | 石蕊 | (乙) |
| ② | 酸 | 堿 | 酚酞 | (甲) |
| ③ | 堿 | 酸 | 酚酞 | (甲) |
| ④ | 酸 | 堿 | 酚酞 | (乙) |
| A. | ①② | B. | ①③ | C. | ②④ | D. | ③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 步驟1為吸熱反應,步驟2為放熱反應 | |
| B. | E2>E3>E1 | |
| C. | 1mol C發生該反應時吸收的能量為E3-E1 | |
| D. | E2-E1<E2-E3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com