
【題目】I.向藍色{[Cu(H2O)4]2+}硫酸銅溶液中加入稍過量的氨水,溶液變?yōu)樯钏{色{[Cu(NH3)4]2+}。
(1)H2O和NH3分子中心原子的雜化類型分別為_______、______。分子中的鍵角:H2O_______NH3填(“大于”或“小于’)。原因是______。
(2)通過上述實驗現(xiàn)象可知,與Cu2+的配位能力:H2O___ NH3(填“大于”或“小于”)。
II.鈾是原子反應堆的原料,常見鈾的化合物有UF4、UO2及(NH4)4 ( UO2(CO3)3〕等。回答下列問題:
(1)UF4用Mg或Ca還原可得金屬鈾。基態(tài)氟原子的價電子排布圖為______;
(2)①已知:(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒間作用力是_____。
3UO2+10NH3↑+9CO2↑+N2↑+9H2O↑,(NH4)4[UO2(CO3)3]存在的微粒間作用力是_____。
a.離子鍵 b.共價鍵 c.配位鍵 d.金屬鍵
② CO32-的空間構型______ ,寫出它的等電子體的化學式(分子、離子各寫一種____ 、____ 。
(3)UO2的晶胞結構如下圖所示:
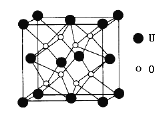
①晶胞中U原子位于面心和頂點,氧原子填充在U原子堆積形成的空隙中,在該空隙中氧原子堆積形成的立體的空間構型為_______(填“立方體”、“四面體、“八面體”);
②若兩個氧原子間的最短距離為a nm,則UD2晶體的密度為______g·cm-3。(列出含a計算式即可。用NA表示阿伏加德羅常數(shù)的值。)
【答案】sp3 sp3 小于 H2O中氧原子有兩對孤電子對,NH3中氮原子有一對電子孤電子對,孤電子對對成鍵電子對的排斥力大于成鍵電子對間的排斥力,所以H2O的鍵角小于NH3的鍵角 小于  abc 平面三角形 SO3 NO3- 立方體
abc 平面三角形 SO3 NO3- 立方體 ![]()
【解析】
I(1)根據(jù)VSEPR理論和雜化軌道理論判斷雜化方式,孤電子對與鍵合電子對之間的斥力大于鍵合電子對與鍵合電子對之間的斥力;
(2)配合物向生成更穩(wěn)定的配合物轉化;
II(1)基態(tài)氟原子的核外電子排布為1s22s22p5,依據(jù)此可以寫出其價電子排布圖;
(2)①(NH4)4[UO2(CO3)3]是離子化合物,銨根與陰離子之間是離子鍵,銨根和[UO2(CO3)3]4-中既有配位鍵又有極性共價鍵;
②用價層電子對互斥理論判斷CO32-的空間構型;等電子體指原子總數(shù)相等,價電子總數(shù)也相等的微粒;
(3)①O原子在U原子組成空隙中,應該有8個,故應在晶胞分割成8個立方體的中心;
②O原子在晶胞分割成8個立方體的中心,連接后為立方體;兩個氧原子間的最短距離為a nm,則晶胞參數(shù)應為2a nm,再用![]() 求晶胞密度。
求晶胞密度。
I、(1)對于H2O,根據(jù)VSEPR理論,O的價層電子對數(shù)=2+![]() =4,則中心O為sp3雜化,對于NH3分子,根據(jù)VSEPR理論,N的價層電子對數(shù)=3+
=4,則中心O為sp3雜化,對于NH3分子,根據(jù)VSEPR理論,N的價層電子對數(shù)=3+![]() =4,則中心N為sp3雜化;H2O中氧原子有兩對孤電子對,NH3中氮原子有一對電子孤電子對,孤電子對與鍵合電子對之間的斥力大于鍵合電子對與鍵合電子對之間的斥力,則分子中的鍵角:H2O小于NH3,
=4,則中心N為sp3雜化;H2O中氧原子有兩對孤電子對,NH3中氮原子有一對電子孤電子對,孤電子對與鍵合電子對之間的斥力大于鍵合電子對與鍵合電子對之間的斥力,則分子中的鍵角:H2O小于NH3,
故答案為:sp3;sp3;小于;H2O中氧原子有兩對孤電子對,NH3中氮原子有一對電子孤電子對,孤電子對對成鍵電子對的排斥力大于成鍵電子對間的排斥力,所以H2O的鍵角小于NH3的鍵角;
(2)配合物向生成更穩(wěn)定的配合物轉化,所以判斷NH3和H2O與Cu2+的配位能力:H2O<NH3,故答案為:<;
II、(1)基態(tài)氟原子的核外電子排布為1s22s22p5,依據(jù)此可以寫出其價電子排布圖為 ;故答案為:
;故答案為: ;
;
(2)①(NH4)4[UO2(CO3)3]是離子化合物,銨根與陰離子之間是離子鍵,銨根和[UO2(CO3)3]4-中既有配位鍵又有極性共價鍵,故答案為:abc;
②CO32-的中心原子C原子的價層電子對數(shù)=3+![]() =3,故其空間構型為平面三角形,與CO32-為等電子體的分子為SO3;離子為NO3-;故答案為:平面三角形;SO3;NO3-;
=3,故其空間構型為平面三角形,與CO32-為等電子體的分子為SO3;離子為NO3-;故答案為:平面三角形;SO3;NO3-;
(3)①由圖可知,U總數(shù)為頂點:![]() ,面心:
,面心:![]() ,為四個;O原子在U原子組成空隙中,應該有8個,故應在晶胞分割成8個立方體的中心,連接后為立方體,答案為:立方體;
,為四個;O原子在U原子組成空隙中,應該有8個,故應在晶胞分割成8個立方體的中心,連接后為立方體,答案為:立方體;
②O原子在晶胞分割成8個立方體的中心,連接后為立方體;兩個氧原子間的最短距離為a nm,則晶胞參數(shù)應為2a nm,所以晶胞密度為:![]() =
=![]() g·cm-3;故答案為:
g·cm-3;故答案為:![]() 。
。


科目:高中化學 來源: 題型:
【題目】實驗室中所用少量氯氣是用MnO2和濃鹽酸制取的,用濃鹽酸200ml,其密度為1.19g·cm-3,HCl的質量分數(shù)為36.5%,跟MnO2恰好完全反應,產(chǎn)生了11.2L(標況)的氯氣。試計算:
①濃鹽酸的物質的量濃度?___
②求參加反應的HCl的物質的量?___
③被氧化的HCl的質量?___
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在容積為2L的密閉容器中,一定條件下發(fā)生化學反應:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反應時 NO和CO各為 4 mol,10 秒鐘后達到化學平衡,測得N2為1 mol。下列有關反應速率的說法中,正確的是( )
N2(g)+2CO2(g) △H= -746.4 kJ·mol-1。起始反應時 NO和CO各為 4 mol,10 秒鐘后達到化學平衡,測得N2為1 mol。下列有關反應速率的說法中,正確的是( )
A. 反應前5秒鐘內(nèi),用NO表示的平均反應速率為0.lmol·L-1·s-1
B. 達到平衡后,升髙溫度,正反應速率將減小,逆反應速率將增大
C. 達到平衡后,反應速率的關系有:V正(CO)=2v逆(N2)
D. 保持容器體積不變,往容器中充入1 mol O2,正、逆反應速率都不改變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組為探究Cl2、Br2、I2的氧化性強弱,設計實驗如下:
資料:稀溴水呈黃色;濃溴水呈紅棕色;碘水呈棕黃色。
實驗Ⅰ |
|
實驗Ⅱ | 取ⅰ中的黃色溶液少許,加入KI溶液,再加入淀粉溶液。 |
(1)ⅰ中反應的離子方程式是__。
(2)實驗Ⅰ中ⅰ和ⅱ可以得出的結論是__。
(3)①甲同學認為:實驗Ⅱ觀察到__現(xiàn)象,得出氧化性Br2>I2。
②乙同學對上述實驗進行反思,認為實驗Ⅱ不能充分證明氧化性Br2>I2,他補做了實驗Ⅲ。
實驗Ⅲ | 另取ⅰ中的黃色溶液少許,先③步驟步驟,,,,,加入足量的NaBr固體,充分振蕩,然后加入KI溶液和淀粉溶液。 |
補做實驗Ⅲ的目的是__。
(4)綜合實驗Ⅰ和Ⅲ,得出氧化性Cl2>Br2>I2。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗現(xiàn)象不能充分說明相應的化學反應是放熱反應的是
選項 | A | B | C | D |
反應裝置或圖像 |
|
|
|
|
實驗現(xiàn)象或圖像信息 | 反應開始后,針筒活塞向右移動 | 反應開始后,甲側液面低于乙側液面 | 溫度計的水銀柱上升 | 反應開始后,氣球慢慢脹大 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋼鐵易生銹是因為在潮濕的空氣里,其表面吸附一層薄薄的水膜,構成了若干微小原電池(如圖所示)。下列有關說法正確的是 ( )

A.負極的電極反應式為Fe-3e-=Fe3+
B.鋼鐵生銹過程中電能轉化為化學能
C.O2在正極參加反應生成OH-
D.為減緩鐵制品生銹,可將其與銅相連
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某興趣小組用電化學法模擬工業(yè)處理SO2。將硫酸工業(yè)尾氣中的SO2通入右圖裝置(電極均為惰性材料)進行實驗。下列說法正確的是
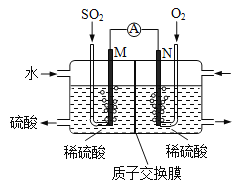
A. N極為負極
B. 反應一段時間后,左側電解質溶液的pH增大
C. M極發(fā)生的電極反應為SO2+2H2O-2e-=SO42-+4H+
D. 在相同條件下,M、N兩極上消耗的氣體體積之比為1:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】我國古代許多著作在化學學科知識上都體現(xiàn)出了一定水平的認識。其中《管子地數(shù)》中有記載:“上有丹沙者,下有黃金;上有慈石者,下有銅金。”
Ⅰ.“丹沙者丹砂也”,丹砂是古代煉丹的重要原料,也是實驗室處理水銀灑落后的產(chǎn)物。你認為丹砂主要成分是_____;(填化學式)“慈石者磁石也”,請寫出磁石溶于鹽酸的離子方程式:_____;
Ⅱ.“銅金者,斑巖銅礦也。”
安徽宣城茶亭銅金礦床是長江中下游成礦帶中新發(fā)現(xiàn)的一個大型斑巖型礦床。斑巖銅礦中Cu主要以銅﹣鐵硫化物(主要為CuFeS2)的形式存在。以黃銅礦(主要成份為CuFeS2,含少量雜質SiO2等)為原料,進行生物煉銅,同時得到副產(chǎn)品綠礬(FeSO47H2O)。其主要流程如圖:
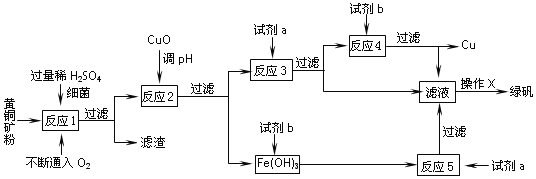
已知:①“反應1”:4CuFeS2 +2H2SO4 +17O2 ═4CuSO4 +2Fe2(SO4)3 +2H2O
②部分陽離子以氫氧化物形式開始沉淀和完全沉淀時溶液的pH如表:
沉淀物 | Cu(OH)2 | Fe(OH)3 | Fe(OH)2 |
開始沉淀pH | 4.7 | 2.7 | 7.6 |
完全沉淀pH | 6.7 | 3.7 | 9.6 |
(1)“反應1”中,每生成1 mol CuSO4轉移電子數(shù)為_____NA;
(2)“試劑a”是_____,“試劑b”是_____;
(3)“反應2”中加CuO調pH為3.7~4.7的目的是_____;
(4)“操作X”應為_____、_____、過濾、洗滌;請簡述上述“操作X”中如何對所得 FeSO47H2O晶體進行洗滌_____;
(5)簡述如何判斷“反應5”已進行完全:_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】金屬(M)空氣電池的工作原理如圖所示。下列說法正確的是( )
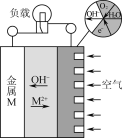
A.金屬M作電池正極
B.電解質是熔融的MO
C.電路中轉移2 mol電子,理論上約消耗空氣56 L
D.電池總反應為2M+O2+2H2O=2M(OH)2
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com