

分析 (1)①裝置為原電池鐵為負極被腐蝕;②裝置為原電池鋅做負極被腐蝕,鐵做正極被保護;③裝置為電解池,鐵做陰極被保護;
(2)由于鋅片和銅片都有銅析出,需要利用差量法進行計算反應消耗的鋅的質量,再根據銅片質量增加的物質的量計算出參加原電池反應的鋅的物質的量,最后計算出原電池工作效率;根據原電池工作中電流方向判斷,鉀離子與電流方向一致;根據電荷守恒判斷鉀離子流到速率;
(3)原電池中陽離子移向正極;依據總反應方程式和負極電極反應計算得到正極電極反應式.
解答 解:(1)①裝置為原電池鐵為負極被腐蝕;②裝置為原電池鋅做負極被腐蝕,鐵做正極被保護;③裝置為電解池,鐵做陰極被保護;①組裝置中鐵電極腐蝕最快;正極反應是氧氣得到電子發生還原反應,電極反應為:O2+2H2O+4e-=4OH-;②③裝置中鐵被保護,③為外加電流陰極保護,效果最好,故答案為:①;O2+4e-+2H2O=4OH-;③;外加電流陰極保護法;
(2)銅片、鋅片表面均有紅色物質銅析出,理解減小的質量為:3.94g-3.84g=0.1g,
根據反應關系式:Zn~Cu△m(減小)
65 64 1
6.5g 0.1g
參加反應的鋅的質量為6.5g,
根據電子守恒,參加原電池反應的鋅的物質的量為n(Zn)=n(Cu)=$\frac{3.84g}{64g/mol}$=0.06mol,該原電池的工作效率為:$\frac{0.06mol×65g/mol}{6.5g}$×100%=60%
銅為正極,鋅為負極,電流在外電路有銅流向鋅,溶液中電流由鋅流向銅,所以鉀離子流向硫酸銅溶液,氯離子流向硫酸鋅溶液;根據電荷守恒可知,如果Zn的消耗速率為1×10-3mol/s,則鉀離子則K+的遷移速率為2×10-3
故答案為:60%;2×10-3;
(3)FePO4+Li$?_{充電}^{放電}$LiFePO4 放電過程是原電池,總反應方程式減去負極反應得到正極電極反應:FePO4+Li++e-=LiFePO4;
故答案為:正;FePO4+Li++e-=LiFePO4.
點評 本題考查了金屬腐蝕與防護的方法和應用,原電電解池電極反應書寫應用,題目難度中等,書寫電極反應式是解題的關鍵.


 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案 期末復習檢測系列答案
期末復習檢測系列答案 超能學典單元期中期末專題沖刺100分系列答案
超能學典單元期中期末專題沖刺100分系列答案 黃岡360度定制密卷系列答案
黃岡360度定制密卷系列答案科目:高中化學 來源: 題型:填空題
 實驗探究是學習化學的一個重要方法,某實驗小組的同學利用下列裝置完成一些常見氣體制備以及相關物質性質探究(夾持裝置及連接橡膠管已省略,其中裝置E有多個供使用).
實驗探究是學習化學的一個重要方法,某實驗小組的同學利用下列裝置完成一些常見氣體制備以及相關物質性質探究(夾持裝置及連接橡膠管已省略,其中裝置E有多個供使用).| 液體試劑 | 固體藥品 |
| 稀硫酸、稀鹽酸、稀硝酸、NaOH溶液、濃氨水、5%H2O2溶液、濃鹽酸、飽和食鹽水 | CaCO3、CaO、MnO2、KMnO4、 堿石灰、Cu、Zn、Na2S |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原子核外電子排布式為1s2的X原子與原子核外電子排布式為1s22s2的Y原子 | |
| B. | 原子核外M層上有5個電子的X原子與原子核外N層上有5個電子的Y原子 | |
| C. | 2p軌道上有一個未成對電子的X原子與3p軌道上有一個未成對電子的Y原子 | |
| D. | 最外層都只有一個電子的X、Y原子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 濃度均為0.2 mol•L-1的AgNO3溶液和CH3COONa溶液等體積混合一定產生CH3COOAg沉淀 | |
| B. | 將0.001 mol•L-1的AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中,先產生Ag2CrO4沉淀 | |
| C. | c(Mg2+)為0.11 mol•L-1的溶液中要產生Mg(OH)2沉淀,溶液的pH要控制在9以上 | |
| D. | 在其他條件不變的情況下,向飽和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
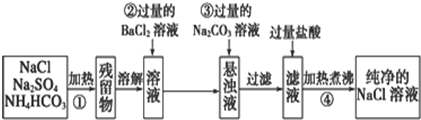
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
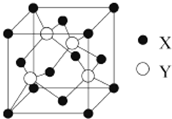 元素X 位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為2.元素Y基態原子的3p軌道上有4個電子.元素Z的原子最外層電子數是其內層的3倍.
元素X 位于第四周期,其基態原子的內層軌道全部排滿電子,且最外層電子數為2.元素Y基態原子的3p軌道上有4個電子.元素Z的原子最外層電子數是其內層的3倍.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
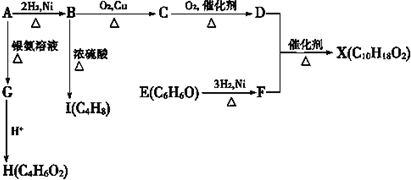
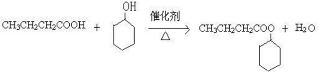 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
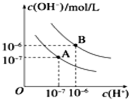 已知水在25℃和100℃時,其電離平衡曲線如圖所示:
已知水在25℃和100℃時,其電離平衡曲線如圖所示:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com