
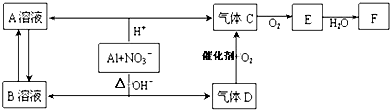
分析 酸性溶液中鋁被氧化生成Al3+,在堿性溶液中被氧化生成AlO2-,在酸性溶液中NO3-被還原生成NO,在堿性溶液中被還原生成氨氣,氨氣催化氧化可以生成一氧化氮和水,一氧化氮可以和氧氣反應生成二氧化氮,故A為硝酸鋁,B為偏鋁酸鹽,C為NO,D為氨氣,E為二氧化氮,F為硝酸,然后結合元素化合物性質及化學用語來解答.
解答 解:酸性溶液中鋁被氧化生成Al3+,在堿性溶液中被氧化生成AlO2-,在酸性溶液中NO3-被還原生成NO,在堿性溶液中被還原生成氨氣,氨氣催化氧化可以生成一氧化氮和水,一氧化氮可以和氧氣反應生成二氧化氮,故A為硝酸鋁,B為偏鋁酸鹽,C為NO,D為氨氣,E為二氧化氮,F為硝酸.
(1)A和B兩溶液混合鋁離子與偏鋁酸根離子水解:Al3++3AlO2-+6H2O=4Al(OH)3↓,生成Al(OH)3,故答案為:Al(OH)3;
(2)氨氣可以和一氧化氮或是二氧化氮發生氧化還原反應生成無毒氣體單質為N2,電子式為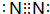 ,故答案為:
,故答案為: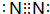 ;
;
(3)由以上分析可知,鋁在堿性條件下與NO3-反應的離子方程式為:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑,
故答案為:8Al+3NO3-+5OH-+2H2O=8AlO2-+3NH3↑;
(4)氨水屬于弱堿,即使過量也不能溶解氫氧化鋁,反應離子方程式為:3NH3•H2O+Al3+═Al(OH)3↓+3 NH4+,
故答案為:3NH3•H2O+Al3+═Al(OH)3↓+3 NH4+;
(5)D生成C屬于氨的催化氧化,反應方程式為:4 NH3+5O2$\frac{\underline{催化劑}}{△}$ 4NO+6 H2O,
故答案為:4 NH3+5O2$\frac{\underline{催化劑}}{△}$ 4NO+6 H2O;
(6)NO難溶于水,NO2溶于生成NO,所以除去NO中混有的NO2的方法是通入水中,反應方程式為:3NO2+H2O═2HNO3+NO,
故答案為:3NO2+H2O═2HNO3+NO;
(7)在反應中鋁失去3個電子,NO3-的還原產物是NO,化合價由+5價降低到+2價,得到3個電子,依據得失電子守恒可知,Al與被還原的NO3-的物質的量之比是1:1,
故答案為:1:1.
點評 本題考查圖框題有關物質的轉化問題,側重Al及其化合物轉化的考查,明確發生的氧化還原反應推斷各物質為解答的關鍵,難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
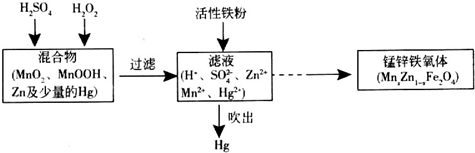
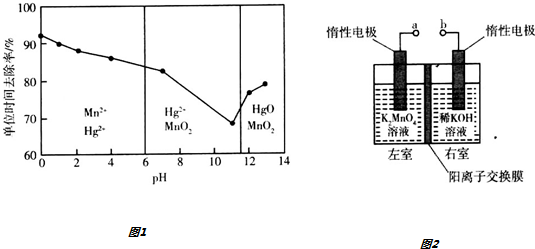
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

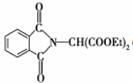 .
.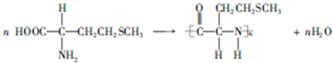 .
. .
.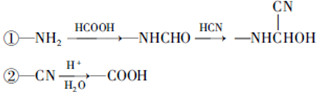
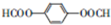
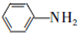 和HCOOH為原料制備化合物
和HCOOH為原料制備化合物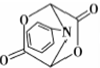 的流程如下:
的流程如下: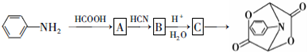
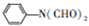 ,C
,C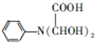 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
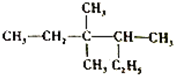
| A. | 2-乙基-3,3-二甲基戊烷 | B. | 3,3,4-三甲基己烷 | ||
| C. | 3,3-甲基-4乙基戊烷 | D. | 2,3,3-三甲基己烷 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 1 mol H2SO4與1 mol Ba(OH)2完全中和所放出的熱量為中和熱 | |
| B. | 由C(石墨)→C(金剛石)△H=+119 kJ•mol-1可知,石墨比金剛石穩定 | |
| C. | 在101 kPa時,2 g H2完全燃燒生成液態水,放出285.8 kJ熱量,氫氣燃燒的熱化學方程式表示為2H2(g)+O2(g)═2H2O(l)△H=+285.8 kJ•mol-1 | |
| D. | 在101 kPa,298 K條件下,1 mol S和2 mol S的燃燒熱相等 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
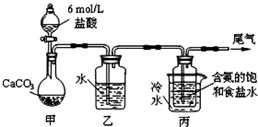 碳酸鈉俗稱純堿,在日常生產和生活中有著廣泛的應用.某化學興趣小組想根據所學知識模擬制備碳酸鈉,方法如下:先以NaCl、NH3、CO2和水等為原料以及如圖所示裝置制取NaHCO3(反應的化學方程式為NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再將NaHCO3制成Na2CO3.
碳酸鈉俗稱純堿,在日常生產和生活中有著廣泛的應用.某化學興趣小組想根據所學知識模擬制備碳酸鈉,方法如下:先以NaCl、NH3、CO2和水等為原料以及如圖所示裝置制取NaHCO3(反應的化學方程式為NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl),然后再將NaHCO3制成Na2CO3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | $\frac{{K}^{+}}{K}$ | B. | $\frac{Mg}{Ca}$ | C. | $\frac{{O}^{2-}}{N{a}^{+}}$ | D. | $\frac{Cl}{C{l}^{-}}$ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com