
| A. | 銅溶于0.5 mol•L-1的硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| B. | 工業上將Cl2通入石灰乳中制漂白粉:Cl2+2OH-═Cl-+ClO-+H2O | |
| C. | 向NH4HSO4溶液中滴加少量Ba(OH)2的溶液:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O | |
| D. | H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO42-+5H2C2O4=2Mn2++10CO2↑+2H2O+6OH- |
分析 A.銅與稀硝酸反應生成的是NO氣體;
B.石灰乳中的氫氧化鈣不能拆開;
C.氫氧化鋇少量,氫離子優先反應,銨根離子不反應;
D.酸性條件下,反應產物中存在生成氫氧根離子.
解答 解:A.銅溶于0.5 mol•L-1的硝酸中生成的是一氧化氮,正確的離子方程式為:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O,故A錯誤;
B.業上將Cl2通入石灰乳中制漂白粉,氫氧化鈣需要保留化學式,正確的離子方程式為:2Ca(OH)2+2Cl2=2Cl-+2ClO-+2H2O+2Ca2+,故B錯誤;
C.向NH4HSO4溶液中滴加少量Ba(OH)2的溶液,氫離子優先反應,反應的離子方程式為:Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O,故C正確;
D.H2C2O4(弱酸)溶液中加入酸性KMnO4溶液,酸性條件下不會生成氫氧根離子,正確的離子方程式為:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O,故D錯誤;
故選C.
點評 本題考查了離子方程式的正誤判斷,為高考的高頻題,屬于中等難度的試題,注意掌握離子方程式的書寫原則,明確離子方程式正誤判斷常用方法:檢查反應物、生成物是否正確,檢查各物質拆分是否正確,如難溶物、弱電解質等需要保留化學式,檢查是否符合原化學方程式等.


科目:高中化學 來源: 題型:選擇題
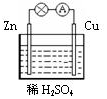
| A. | 鋅是該電池的負極 | |
| B. | 鋅電極上發生氧化反應 | |
| C. | 銅電極的電極反應式為:2H++2e-=H2↑ | |
| D. | 若將電解質溶液換成AgNO3溶液,兩電極的反應式均發生改變 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 閉合K1,斷開K2,可防止Fe發生吸氧腐蝕 | |
| B. | 閉合K1,斷開K2,Cl-向石墨電極移動 | |
| C. | 閉合K2,斷開K1,可用于制備家用消毒液(主要成分NaClO) | |
| D. | 閉合K2,斷開K1,電解質溶液中Na+的濃度不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
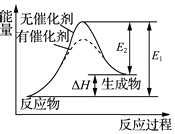
| A. | 分子式為C2H4O的有機化合物性質相同 | |
| B. | 氯水和二氧化硫都具有漂白作用,兩者漂白原理不相同 | |
| C. | 某反應過程中的能量變化如圖所示,可見催化劑能改變該反應的焓變 | |
| D. | 等質量的銅粉按a、b兩種途徑完全轉化,途徑a和途徑b消耗的H2SO4相等 途徑a:Cu$→_{△}^{O_{2}}$CuO$→_{△}^{稀H_{2}SO_{4}}$CuSO4;途徑b:Cu$→_{△}^{濃H_{2}SO_{4}}$CuSO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
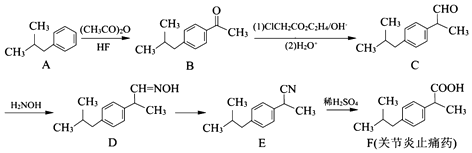
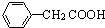 (任寫一種);X有多種同分異構體,滿足下列條件的X的同分異構體共有3種.
(任寫一種);X有多種同分異構體,滿足下列條件的X的同分異構體共有3種.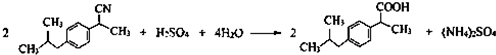 .
.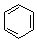 $→_{AlCl_{3}}^{RCl}$
$→_{AlCl_{3}}^{RCl}$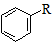

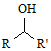 $\stackrel{CO、Pd}{→}$
$\stackrel{CO、Pd}{→}$ R、R′表示烴基
R、R′表示烴基 、苯、(CH3CO)2O為原料來合成,寫出有關的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{濃硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.
、苯、(CH3CO)2O為原料來合成,寫出有關的合成路線流程圖(無機試劑任選).合成路線流程圖示例如下:CH3CH2Br$→_{△}^{NaOH溶液}$CH3CHOH$→_{濃硫酸,△}^{CH_{3}COOH}$CH3COOCH2CH3.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
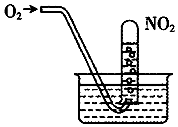
| A. | 當試管內溶液的pH值不再變化,說明NO2全部轉化為HNO3 | |
| B. | 當試管氣體不是紅棕色時,說明NO2全部轉化為HNO3 | |
| C. | 水槽內的水改為稀鹽酸,有利于吸收NO2 | |
| D. | 水槽內的水改為稀NaOH溶液,有利于吸收NO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Cu(OH)2+HCl Cu(OH)2+CH3COOH | |
| B. | NaHCO3+H2SO4 Na2CO3+HCl | |
| C. | NaHCO3+NaOH Ca(HCO3)2+NaOH | |
| D. | BaCl2+H2SO4 Ba(NO3)2+H2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 700C時,向純水中加人H3PO4后,水的Kw減小 | |
| B. | 700C的Na2CO3溶液中c(Na+)>c(CO32-)c(HCO3-)>c(OH-)>c(H+) | |
| C. | 700C的H2S04溶液中c(H+)=c(OH-)+2c(SO42-) | |
| D. | 將室溫下0.1 mol/L的NaOH溶液加熱至700C時,c(OH-)/c(H+)隨之增大 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com