
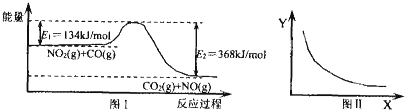
| A. | 該反應的焓變△H=+234 kJ•mol-1 | |
| B. | 若X表示溫度,則Y表示的可能是CO2的物質的量濃度 | |
| C. | 若X表示CO的起始濃度,則Y表示的可能是NO2的轉化率 | |
| D. | 若X表示反應時間,則Y表示的可能是混合氣體的密度 |
分析 A.反應的焓變=拆化學鍵吸收能量-形成化學鍵放出能量;
B.反應是放熱反應,溫度升高反應逆向進行;
C.CO的起始濃度越大,NO2的轉化率越大;
D.反應前后氣體體積不變,氣體形成的化學平衡質量守恒.
解答 解:A.反應的焓變△H=E1-E2=134KJ/mol-368KJ/mol=-234kJ/mol,故A錯誤;
B.該反應是放熱反應,升溫,化學平衡逆向進行,二氧化碳濃度減小,則若X表示溫度,則Y表示的可能是CO2的物質的量濃度,故B正確;
C.CO的起始濃度越大,NO2的轉化率越大,若X表示CO的起始濃度,則NO2的轉化率增大,圖象不符合,故C錯誤;
D.氣體形成的平衡體系中氣體質量不變,反應前后體積不變,所以密度不變,圖象不符合,故D錯誤;
故選B.
點評 本題考查了反應焓變的含義和計算、化學平衡的影響因素、反應物的轉化率變化,題目難度中等,注意把握反應熱的計算方法、以及對圖象的分析理解分析方法,側重于考查學生的分析能力和應用能力.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
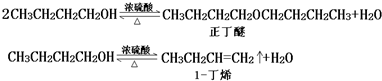
| 化合物 | 密度(g•cm-3) | 水溶性 | 沸點(℃) |
| 冰乙酸 | 1.05 | 易溶 | 118.1 |
| 正丁醇 | 0.80 | 微溶 | 117.2 |
| 正丁醚 | 0.77 | 不溶 | 142.0 |
| 乙酸正丁酯 | 0.90 | 微溶 | 126.5 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

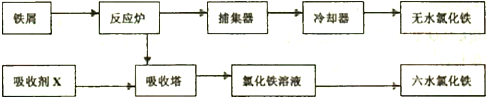
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
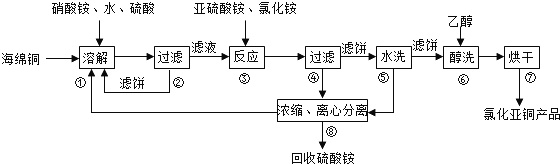
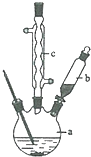 苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅體之一.下面是它的一種實驗室合成路線:
苯乙酸銅是合成優良催化劑、傳感材料--納米氧化銅的重要前驅體之一.下面是它的一種實驗室合成路線: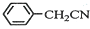 +H2O+H2SO4$\stackrel{100~130℃}{→}$
+H2O+H2SO4$\stackrel{100~130℃}{→}$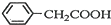 +NH4HSO4
+NH4HSO4 +Cu(OH)2→(
+Cu(OH)2→(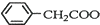 )2Cu+H2O
)2Cu+H2O查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-1366.8)kJ•mol-1 | |
| B. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+1366.8)kJ•mol-1 | |
| C. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=($\frac{10Q}{9}$-151.9)kJ•mol-1 | |
| D. | CxHy(l)+(x+$\frac{y}{4}$)O2(g)=xCO2(g)+$\frac{y}{2}$H2O(l)△H=(-$\frac{10Q}{9}$+151.9)kJ•mol-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 化學鍵 | C-H | C═C | C-C | H-H |
| 鍵能/kJ•mol-1 | 414.4 | 615.3 | 347.3 | 435.3 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com