
分析 氯水顯酸性,可以用堿性物質吸收;氯氣和氫氧化鈣反應生成氯化鈣、次氯酸鈣和水,次氯酸鈣和二氧化碳反應生成碳酸鈣,碳酸鈣和鹽酸反應生成二氧化碳.
解答 解:氯水顯酸性,可以用堿性物質氫氧化鈉溶液吸收,氯氣和氫氧化鈉溶液反應生成氯化鈉、次氯酸鈉和水,反應方程式為:2NaOH+Cl2═NaClO+NaCl+H2O;氯氣和氫氧化鈣反應生成氯化鈣、次氯酸鈣和水,漂白粉的有效成分是Ca(ClO)2,次氯酸鈣和二氧化碳反應生成碳酸鈣,反應方程式為:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,碳酸鈣和鹽酸反應生成二氧化碳,所以長期露置于空氣中的漂白粉,加稀鹽酸后產生的氣體是二氧化碳,故選C,
故答案為:NaOH;2NaOH+Cl2═NaClO+NaCl+H2O;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O; C.
點評 本題考查了次氯酸的漂白性、氯氣的性質,知道次氯酸漂白性原理,會根據氯氣和水反應原理分析氯氣和堿溶液反應原理,注意次氯酸是強氧化性弱酸.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題

| A. | 由圖Ⅰ知,反應在T1、T3處達到平衡,且該反應的△H<0 | |
| B. | 已知圖Ⅱ△H<0,由圖Ⅱ知,t3時采取的措施是降低反應體系溫度 | |
| C. | 由圖Ⅱ知,反應在t6時,NH3體積分數最大 | |
| D. | Ⅲ在10L容器、850℃時反應,由圖知,到4min時,反應放出5.16kJ的熱量 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | I3-溶液中存在如下平衡:I3-?I2+I- | |
| B. | 在KI3溶液中加入AgNO3溶液,會析出AgI3沉淀 | |
| C. | 向KI3溶液中通入Cl2,溶液顏色會加深 | |
| D. | 配制碘水時,加入KI可增大I2的溶解度 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18g水中所含的電子數為8NA | |
| B. | 常溫常壓下,28g氮氣所含的原子數為2NA | |
| C. | 0.5molCuO的摩爾質量為40g/mol | |
| D. | 22.4L甲烷(CH4)所含的原子數為5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水泥是建筑工業的基礎材料,可用黏土、石灰石等原料來制得 | |
| B. | 常溫下,二氧化硅可與NaOH溶液反應 | |
| C. | 向硅酸鈉溶液中滴加稀鹽酸,溶液中不會出現沉淀 | |
| D. | 晶體硅是良好的半導體材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
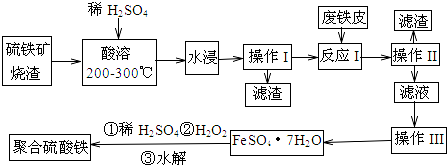
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com