
| 弱酸 | HCOOH | HCN | H2CO3 |
| 電離平衡常數 ( 25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
| A. | 2CN-+H2O+CO2→2HCN+CO32- | |
| B. | 2HCOOH+CO32-→2HCOO-+H2O+CO2↑ | |
| C. | 中和等體積、等pH的HCOOH和HCN消耗NaOH的量前者小于后者 | |
| D. | 等體積、等濃度的HCOONa和NaCN溶液中所含離子總數前者小于后者 |
分析 弱酸的電離平衡常數越大,其酸性越強,等pH的弱酸溶液,酸性越強的酸其物質的量濃度越小,弱酸根離子水解程度越小,結合強酸能和弱酸鹽反應制取弱酸分析解答.
解答 解:酸的電離平衡常數HCOOH>H2CO3>HCN>HCO3-,則酸根離子水解程度CO32->CN->HCO3->HCOO-,
A.酸的電離平衡常數越大,酸的酸性越強,強酸能夠制取弱酸,所以二者反應生成HCN和HCO3-,離子方程式為CN-+H2O+CO2═HCN+HCO3-,故A錯誤;
B.酸性強弱順序是HCOOH>H2CO3>HCN>HCO3-,強酸能和弱酸鹽反應生成弱酸,所以反應方程式為2HCOOH+CO32-=2HCOO-+H2O+CO2↑,故B正確;
C.等pH、等體積的HCOOH和HCN,n(HCN)>n(HCOOH),中和酸需要堿的物質的量與酸的物質的量、酸的元數成正比,所以中和等體積、等pH的HCOOH和HCN消耗NaOH的量前者小于后者,故C正確;
D.根據電荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即離子總數是n(Na+ )+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸鈉中離子濃度大,故D錯誤;
故選AD.
點評 本題考查了弱電解質的電離,明確弱電解質電離平衡常數與酸性強弱、酸根離子的水解程度的關系是解本題關系,再結合強酸制取弱酸、酸堿中和反應來分析解答,易錯選項是D,注意從電荷守恒的角度解答該題.


 寒假天地重慶出版社系列答案
寒假天地重慶出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | pH小于5.6的降雨稱為酸雨 | |
| B. | 充分利用太陽能有助于“節能減排” | |
| C. | 在燃煤中加入適量石灰石,有助于環境保護 | |
| D. | 含磷洗滌劑易被細菌分解,不會導致水體污染 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
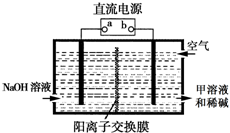 X、Y、Z、Q、R是五種短周期元素,原子序數依次增大.X元素一種原子核無中子.Y兩元素最高正價與最低負價之和均為0;Q與X同主族;Z、R分別是地殼中含量最高的非金屬元素和金屬元素.
X、Y、Z、Q、R是五種短周期元素,原子序數依次增大.X元素一種原子核無中子.Y兩元素最高正價與最低負價之和均為0;Q與X同主族;Z、R分別是地殼中含量最高的非金屬元素和金屬元素.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 失電子越多,還原性就一定越強 | |
| B. | 某元素由單質變為化合物,該元素有可能被氧化也有可能被還原 | |
| C. | 某物質焰色反應呈黃色,該物質一定含鈉單質,可能含鉀單質 | |
| D. | 金屬氧化物一定是堿性氧化物 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
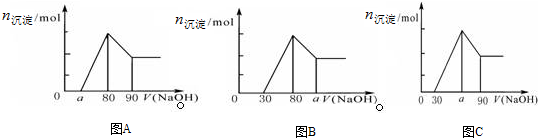
| A. | A圖中a的取值范圍為 0≤a<50 | |
| B. | A圖中$\frac{n(Mg)}{n(Al)}$的最大值為2.5 | |
| C. | 若將關系圖改為B圖時,則a的取值范圍為80<a<90 | |
| D. | 若將關系圖改為C圖時,則a的取值范圍為75<a<90 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 給燒瓶加熱時,要墊上石棉網 | |
| B. | 給試管里的液體加熱,液體體積不超過試管容積的三分之一 | |
| C. | 用托盤天平稱量氫氧化鈉固體時,應該放在小燒杯里稱量 | |
| D. | 酒精燈打翻用水撲滅 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
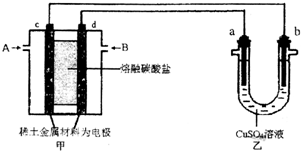
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Al3+、Na+、AlO2-、Cl- | B. | Mg2+、Cu2+、SO42-、HCO3- | ||
| C. | Fe3+、Na+、SCN-、CO32- | D. | K+、Na+、Cl-、SO42- |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com