
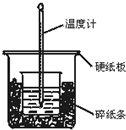
 通過測定反應過程中所放出的熱量可計算中和熱.50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在圖示的裝置中進行中和反應.回答下列問題:
通過測定反應過程中所放出的熱量可計算中和熱.50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液在圖示的裝置中進行中和反應.回答下列問題:分析 (1)根據量熱計的構造來判斷該裝置的缺少儀器;
(2)不蓋硬紙板,會有一部分熱量散失;
(3)根據中和熱的概念和實質來回答;
(4)先判斷溫度差的有效性,然后求出溫度差平均值;再根據Q=m•c•△T計算反應放出的熱量,然后根據△H=-$\frac{Q}{n}$kJ/mol計算出反應熱.
解答 解:(1)根據量熱計的構造可知該裝置的缺少儀器是環形玻璃攪拌棒,故答案為:環形玻璃攪拌棒;
(2)大燒杯上如不蓋硬紙板,會有一部分熱量散失,求得的中和熱數值將會減小,故答案為:偏小;
(3)改用60mL 0.50mol/L鹽酸跟50mL 0.55mol/LNaOH溶液進行反應,生成水的量增多,所放出的熱量偏高,但是中和熱的均是強酸和強堿反應生成1mol水時放出的熱,中和熱相等;
故答案為:相等;因為中和熱是指酸跟堿發生中和反應生成1 mol H2O所放出的能量,與酸堿的用量無關;
(4)三次平行操作測得終止溫度與起始溫度差(t2-t1)分別為:①3.2℃②2.2℃③3.0℃,第②組舍去,溫度差的平均值為3.1℃,50mL 0.50mol/L鹽酸與50mL 0.55mol/LNaOH溶液進行中和反應生成水的物質的量為0.05L×0.5mol/L×2=0.025mol,溶液的質量為100ml×1g/ml=100g,則生成0.025mol水放出的熱量為Q=m•c•△T=100g×4.18J/(g•℃)×3.1℃=1259.8J,即1.2598kJ,所以實驗測得的中和熱△H=-$\frac{1.2598kJ}{0.025mol}$=-51.8kJ/mol,該反應的熱化學方程式:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8 kJ/mol;
故答案為:HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l)△H=-51.8 kJ/mol.
點評 本題考查中和熱的測定與計算,題目難度中等,注意理解中和熱的概念是解題的關鍵.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 在溫度為373K時,將0.100mol無色的N2O4氣體放入1L抽空的密閉容器中,立刻出現紅棕色,直至建立N2O4?2NO2的平衡.如圖是隔一定時間測定到的N2O4的濃度(縱坐標為N2O4的濃度,橫坐標為時間)
在溫度為373K時,將0.100mol無色的N2O4氣體放入1L抽空的密閉容器中,立刻出現紅棕色,直至建立N2O4?2NO2的平衡.如圖是隔一定時間測定到的N2O4的濃度(縱坐標為N2O4的濃度,橫坐標為時間)查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 已知:1mol C-H鍵完全斷裂時吸收熱量412kJ,1mol C-C鍵完全斷裂時吸收熱量348kJ1mol C=C鍵完全斷裂吸收熱量612kJ,1mol H-H鍵完全斷裂時吸收熱量436kJ.上述反應的△H等于( ) kJ•mol-1.
已知:1mol C-H鍵完全斷裂時吸收熱量412kJ,1mol C-C鍵完全斷裂時吸收熱量348kJ1mol C=C鍵完全斷裂吸收熱量612kJ,1mol H-H鍵完全斷裂時吸收熱量436kJ.上述反應的△H等于( ) kJ•mol-1.| A. | -124 | B. | +124 | C. | -288 | D. | +288 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 圖1中,插入海水中的鐵棒,越靠近底端腐蝕越嚴重 | |
| B. | 圖2中,往燒杯中滴加幾滴KSCN溶液,溶液變血紅色 | |
| C. | 圖3中,開關由M改置于N時,Cu-Zn合金的腐蝕速率增大 | |
| D. | 圖4中,采用了犧牲陽極的陰極保護法來防止地下鋼鐵管道的腐蝕 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 每消耗1molH2(g)釋放483.6kJ的能量 | |
| B. | 每生成1molH2O(g)釋放483.6kJ的能量 | |
| C. | 方程式中H2(g)計量數改變△H值不變 | |
| D. | 同條件下2molH2O(g)完全分解吸收的能量為483.6kJ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com