
 B+D在四種不同條件下進行,B、D起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:
B+D在四種不同條件下進行,B、D起始濃度為0,反應物A的濃度(mol/L)隨反應時間(min)的變化情況如下表:| 實驗序號 | 濃度(mol/L) | 時間(min) | |||||||
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | |||
| 1 | 溫 度 | 8000C | 1.0 | 0.80 | O.64 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 8000C | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | |
| 3 | 8000C | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | |
| 4 | 8200C | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 | |
 B+D的平衡常數= ,
B+D的平衡常數= ,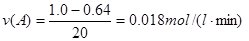 ;
;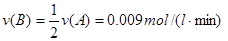
 B+D的平衡常數= 0.25;實驗2中達到平衡時A的轉化率=50%
B+D的平衡常數= 0.25;實驗2中達到平衡時A的轉化率=50%

科目:高中化學 來源:不詳 題型:填空題
 2SO3,如果2min內SO2的濃度由6 mol/L下降為2 mol/L,那么,用SO2濃度變化來表示的化學反應速率為____________,用O2濃度變化來表示的反應速率為_____________。
2SO3,如果2min內SO2的濃度由6 mol/L下降為2 mol/L,那么,用SO2濃度變化來表示的化學反應速率為____________,用O2濃度變化來表示的反應速率為_____________。 2SO3 △H<0 達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況。
2SO3 △H<0 達到平衡時,由于條件改變而引起反應速度和化學平衡的變化情況。
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.溫度過高對合成氨不利 |
| B.合成氨在高壓下進行是有利的 |
| C.合成氨在高溫下進行和加入催化劑都能使化學反應速率加快 |
| D.增大N2的濃度可提高平衡混合物中NH3的含量 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 E(g)。當反應進行到4min時達到平衡,測得M的濃度為0.2 mol·L-1。下列說法正確的是
E(g)。當反應進行到4min時達到平衡,測得M的濃度為0.2 mol·L-1。下列說法正確的是| A.4 min時,M的轉化率為80% |
| B.4 min時,用M表示的反應速率為0.8 mol·L-1·min-1 |
| C.4 min后,向容器中充入不參與反應的稀有氣體,M的物質的量減小 |
| D.2 min時,M的物質的量濃度為0.6 mol·L-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題


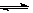 2CO(g),K1
2CO(g),K1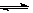 H2(g)+CO2(g),K2
H2(g)+CO2(g),K2 CO(g)+H2(g),K3
CO(g)+H2(g),K3 H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:
H2(g)+CO2(g),該反應平衡常數隨溫度的變化如下:| 溫度/℃ | 400 | 500 | 800 |
| 平衡常數K | 9.94 | 9 | 1 |
 2NO2(g);△H=Q(Q>0),在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。
2NO2(g);△H=Q(Q>0),在溫度為T1、T2時,平衡體系中NO2的體積分數隨壓強變化曲線如圖所示。下列說法正確的是 。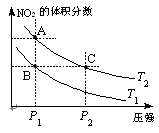
 2N2(g) + 3H2O(g)
2N2(g) + 3H2O(g)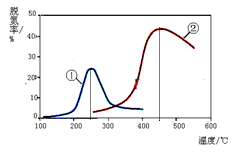
 以下說法正確的是(注:脫氮率即氮氧化物轉化率)
以下說法正確的是(注:脫氮率即氮氧化物轉化率)查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 在容積不變的密閉容器中達到平衡,且起始時A與B的物質的量之比為a:b。則
在容積不變的密閉容器中達到平衡,且起始時A與B的物質的量之比為a:b。則查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol/L。則該條件下反應的平衡常數K= ,SO2的平衡轉化率= 。
2SO3(g)在一定條件下達到平衡,測得c(SO3)=0.040 mol/L。則該條件下反應的平衡常數K= ,SO2的平衡轉化率= 。| A.升高溫度 | B.降低溫度 | C.增大壓強 |
| D.減小壓強 (E)加入催化劑 (G)移出氧氣 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 O外,還有H
O外,還有H O
O ;碳元素的氫化物除CH
;碳元素的氫化物除CH 外,還有C
外,還有C H
H 等;與之相似的氮元素的氫化物除外,還有N
等;與之相似的氮元素的氫化物除外,還有N H
H 等。
等。 H
H 是“神六”發射時火箭所用的液體燃料,液態的四氧化二氮作氧化劑,此液態燃料的優點是產生的能量大且無污染。已知40g N
是“神六”發射時火箭所用的液體燃料,液態的四氧化二氮作氧化劑,此液態燃料的優點是產生的能量大且無污染。已知40g N H
H 在火箭發射時反應中放出710kJ熱量,寫出火箭發射時該反應的熱化學方程式: 。
在火箭發射時反應中放出710kJ熱量,寫出火箭發射時該反應的熱化學方程式: 。 對農業、化學、國防工業具有重要意義。其合成原理為:
對農業、化學、國防工業具有重要意義。其合成原理為:



 和6 molH
和6 molH 通入到一個固定容積為VL的密閉容器中,當反應達到平衡時,容器內氣體的壓強為起始時的80%,則
通入到一個固定容積為VL的密閉容器中,當反應達到平衡時,容器內氣體的壓強為起始時的80%,則 的轉化率= 。
的轉化率= 。 = (只列數字表達式)
= (只列數字表達式) 、bmolH
、bmolH 、cmolNH
、cmolNH ,平衡時NH
,平衡時NH 的物質的量分數為25%,則:
的物質的量分數為25%,則:| A.一定相等 |
| B.前者一定小于后者 |
| C.前者等于或小于后者 |
| D.前者等于或大于后者 |
 和
和 ,同
,同
 (填“﹥”、“﹤
(填“﹥”、“﹤ ”或
”或 “=”)
“=”)查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2A(g) + B(g) =" 2C" (g) 。若經2s后測得C的濃度為 0.6mol/L ,下列說法正確的是
2A(g) + B(g) =" 2C" (g) 。若經2s后測得C的濃度為 0.6mol/L ,下列說法正確的是

A.用物質A表示的反應速率為0.6mol/(L·s) | B.用物質B表示的反應速率為0.3mol/(L·s) | C.2s時物質A的轉化率為30% | D.2s時物質B的濃度為0.3mol/L |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com