
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .元素⑩名稱為溴單質與水反應化學方程式Br2+H2O=HBr+HBrO.
.元素⑩名稱為溴單質與水反應化學方程式Br2+H2O=HBr+HBrO.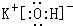 .
.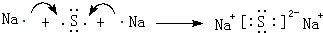 ,該化合物屬于離子(填“共價”或“離子”)化合物.
,該化合物屬于離子(填“共價”或“離子”)化合物.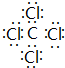 、
、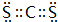 .
.分析 由元素在周期表中的位置可知,①為C、②為N、③為O、④為Na、⑤為Si、⑥為S、⑦為Cl、⑧為Ar、⑨為K、⑩為Br.
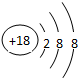
(1)稀有氣體Ar原子最外層為穩定結構,化學性質最不活潑,原子核外有18個電子,有3個電子層,各層電子數為2、8、8;⑩為Br,溴單質與水反應生成HBr與HBrO;
(2)在最高價氧化物的水化物中,酸性最強的是高氯酸;上述元素中K的金屬性最強,故KOH的堿性最強,由鉀離子與氫氧根離子構成;
(3)②的最高價氧化物為五氧化二氮,其對應水化物為HNO3,足量的Fe與稀硝酸反應生成硝酸亞鐵、NO與水;
(4)元素④與⑥的化合物為Na2S,由鈉離子與硫離子構成;
(5)①與⑦形成的化合物為CCl4,屬于共價化合物,分子中碳原子與氯原子之間形成1對共用電子對;①與⑥形成的化合物為CS2,屬于共價化合物,分子中碳原子與硫原子之間形成2對共用電子對;
(6)③、⑥氫化物分別為H2O、H2S,由于水分子之間存在氫鍵,沸點較高;
(7)電子層結構相同的離子,核電荷數越大離子半徑越小,電子層越多離子半徑越大;
(8)結合元素質量分數計算N、S原子數目之比,在結合相對分子質量確定分子式;
(9)④和③兩種元素形成含有非極性鍵的化合物為過氧化鈉,鑒別該化合物中Na元素常用方法 為焰色反應,過氧化鈉與二氧化碳反應可以得到氧氣,同時生成碳酸鈉.
解答 解:由元素在周期表中的位置可知,①為C、②為N、③為O、④為Na、⑤為Si、⑥為S、⑦為Cl、⑧為Ar、⑨為K、⑩為Br.
(1)稀有氣體Ar原子最外層為穩定結構,化學性質最不活潑,原子核外有18個電子,原子結構示意圖為 ;⑩為溴元素,溴單質與水反應生成HBr與HBrO,反應方程式為:Br2+H2O=HBr+HBrO,
;⑩為溴元素,溴單質與水反應生成HBr與HBrO,反應方程式為:Br2+H2O=HBr+HBrO,
故答案為:Ar; ;溴;Br2+H2O=HBr+HBrO;
;溴;Br2+H2O=HBr+HBrO;
(2)在最高價氧化物的水化物中,酸性最強的是HClO4;上述元素中K的金屬性最強,故KOH的堿性最強,由鉀離子與氫氧根離子構成,電子式為: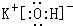 ,
,
故答案為:HClO4;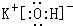 ;
;
(3)②的最高價氧化物為N2O5,其對應水化物為HNO3,足量的Fe與稀硝酸反應生成硝酸亞鐵、NO與水,反應離子方程式為:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,
故答案為:N2O5;3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O;
(4)元素④與⑥的化合物為Na2S,由鈉離子與硫離子構成,屬于離子化合物,用電子式表示其形成為: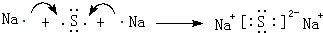 ,
,
故答案為: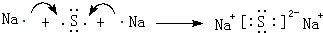 ;離子;
;離子;
(5)①與⑦形成的化合物為CCl4,屬于共價化合物,分子中碳原子與氯原子之間形成1對共用電子對,電子式為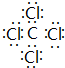 ;①與⑥形成的化合物為CS2,屬于共價化合物,分子中碳原子與硫原子之間形成2對共用電子對,電子式為
;①與⑥形成的化合物為CS2,屬于共價化合物,分子中碳原子與硫原子之間形成2對共用電子對,電子式為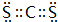 ,
,
故答案為: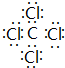 ;
;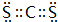 ;
;
(6)③、⑥氫化物分別為H2O、H2S,由于H2O分子之間存在氫鍵,H2O的沸點高于H2S,故答案為:H2O的沸點高于H2S; 由于H2O分子之間存在氫鍵;
(7)電子層結構相同的離子,核電荷數越大離子半徑越小,電子層越多離子半徑越大,故離子半徑:S2->Cl->Na+,故答案為:S2->Cl->Na+;
(8)S和N形成的一種化合物相對分子質量在170~190之間,且S的質量分數約為70%,則N元素質量分數為30%,則分子中S、N原子數目之比=$\frac{70%}{32}$:$\frac{30%}{14}$≈1:1,令分子式為(SN)n,則170<46n<190,可以確定3.7<n<4.13,故n=4,則分子式為:S4N4,
故答案為:S4N4;
(9)④和③兩種元素形成含有非極性鍵的化合物為Na2O2,鑒別該化合物中Na元素常用方法為焰色反應,利用該化合物制取氧氣的化學方程式為2Na2O2+2CO2=2Na2CO3+O2,
故答案為:Na2O2;焰色反應;2Na2O2+2CO2=2Na2CO3+O2.
點評 本題考查元素周期律和元素周期表的綜合應用,側重常用化學用語的考查,難度不大,注意基礎知識的理解掌握.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題


查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 標準狀況下,2.24LSO3含有的分子數等于0.1NA | |
| B. | 1 mol Na2O2所含陰離子數為2NA | |
| C. | 常溫常壓下,16gO2 和O3的混合氣體含有的氧原子數為NA | |
| D. | 常溫常壓和光照條件下,33.6 LCl2與3.0g H2反應,生成的HCl分子數目為3NA |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高分子膜 | B. | 醫用高分子材料 | C. | 生物高分子材料 | D. | 液晶高分子材料 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CH3OH | B. | (CH3)2CHOH | C. | (CH3)3COH | D. | (CH3)3CCH2OH |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | A<B<C<D | B. | D<A<B=C | C. | A=B<C=D | D. | D<A<B<C |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com