
分析 水的電離吸熱,故升高溫度,水的電離平衡右移,水的離子積常數增大;根據c(H+)和c(OH-)的相對大小來判斷溶液的酸堿性,據此分析.
解答 解:水的電離是吸熱的,升高溫度,水的電離平衡右移,水的離子積常數增大,若水的Kw=1×10-12>1×10-14,則溫度高于25℃,該溫度下,c(H+)=1×10-7mol•L-1的溶液,c(OH-)=1×10-5mol•L-1,氫氧根離子濃度大于氫離子濃度,顯示堿性.故答案為:>;水的電離是吸熱的,升高溫度,水的電離平衡右移,水的離子積常數增大;堿性.
點評 本題考查了溶液酸堿性的判斷以及水的電離平衡的影響因素知識,注意溶液的酸堿性不能根據溶液的pH判斷,為易錯點.


科目:高中化學 來源: 題型:解答題
| 序號 | 操作步驟 | 現象 |
| 實驗1 | 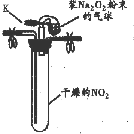 ①按如圖組裝儀器,打開K,將氣球中的Na2O2粉末導入試管中,振蕩,充分反應 | 試管內紅棕色消失,氣球變癟 |
| ②試管冷卻后,打開膠塞,加入5mL蒸餾水 | 未見紅棕色氣體,試管底部固體全部溶解得澄清溶液 |
| 序號 | 操作步驟 | 現象 |
| 實驗2 | 取實驗1所得清液, 向其中加入少量MnO2粉末,待不再產生氣泡后,靜置后取上層清液,再調節此溶液pH至7左右 | / |
| 實驗3 | 取實驗2后的清液2mL,加入2滴0.1%的酸性KMnO4溶液 |
| 序號 | 操作步驟 | 現象 |
| 實驗4 | ①向試管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO3溶液,振蕩,再向試管中加入0.5mL98%的濃硫酸 | 滴入NaNO3溶液,無明顯變化,加入濃硫酸后,溶液變棕色 |
| ②向試管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO2溶液,振蕩,再向試管中加入0.5mL98%的濃硫酸 | 加入NaNO2溶液,立即變棕色,加入濃硫酸后,溶液無明顯變化 | |
| ③向試管中加入2mL新制FeSO4溶液,再加入10滴實驗2后的清液,振蕩,再加0.5mL98%的濃硫酸 | 滴加實驗2得到的清液后,溶液立即變淺棕色,加入濃硫酸后,溶液變深棕色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容器里氣體的密度為40 g/L | |
| B. | SO3的分解率為30% | |
| C. | 在這10 min內的平均速率為v(O2)=0.05 mol•L-1•min-1 | |
| D. | 化學反應速率:v(Ag2SO4)=v(SO3) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 采用加熱蒸干高錳酸鉀溶液的方法獲得高錳酸鉀晶體 | |
| B. | 過濾時,為了加快過濾速率,可用玻璃棒在漏斗內攪拌 | |
| C. | 用冷卻結晶法提純含有少量氯化鈉雜質的硝酸鉀固體 | |
| D. | 某無色溶液中加入稀鹽酸無現象,再加Ba(NO3)2溶液,產生白色沉淀,則原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:計算題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com