
| 序號 | 操作步驟 | 現象 |
| 實驗1 | 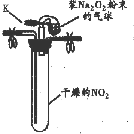 ①按如圖組裝儀器,打開K,將氣球中的Na2O2粉末導入試管中,振蕩,充分反應 | 試管內紅棕色消失,氣球變癟 |
| ②試管冷卻后,打開膠塞,加入5mL蒸餾水 | 未見紅棕色氣體,試管底部固體全部溶解得澄清溶液 |
| 序號 | 操作步驟 | 現象 |
| 實驗2 | 取實驗1所得清液, 向其中加入少量MnO2粉末,待不再產生氣泡后,靜置后取上層清液,再調節此溶液pH至7左右 | / |
| 實驗3 | 取實驗2后的清液2mL,加入2滴0.1%的酸性KMnO4溶液 |
| 序號 | 操作步驟 | 現象 |
| 實驗4 | ①向試管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO3溶液,振蕩,再向試管中加入0.5mL98%的濃硫酸 | 滴入NaNO3溶液,無明顯變化,加入濃硫酸后,溶液變棕色 |
| ②向試管中加入2mL新制FeSO4溶液,再加入10滴0.1mol•L-1NaNO2溶液,振蕩,再向試管中加入0.5mL98%的濃硫酸 | 加入NaNO2溶液,立即變棕色,加入濃硫酸后,溶液無明顯變化 | |
| ③向試管中加入2mL新制FeSO4溶液,再加入10滴實驗2后的清液,振蕩,再加0.5mL98%的濃硫酸 | 滴加實驗2得到的清液后,溶液立即變淺棕色,加入濃硫酸后,溶液變深棕色 |
分析 (1)NO2 與Na2O2 的反應,有兩種情況,NO2能被Na2O2氧化或NO2能被Na2O2還原;
(2)①濃硝酸具有強氧化性,銅和濃硝酸反應生成硝酸銅、二氧化氮和水;不能根據“氣球變癟”的現象推斷假設一成立,“氣球變癟”說明氣體的體積縮小,但假設1、2兩反應反應后氣體的體積都縮小;
(3)①實驗2 的主要目的是除去溶液中H2O2,防止對后續實驗的干擾,實驗需選擇除去過氧化氫的試劑,可選擇二氧化錳,二氧化猛能催化過氧化氫的分解,且產物為水和氧氣,然后取上層清夜進行實驗;
②NO2-具有還原性,紫紅色的酸性KMnO4 溶液具有氧化性,兩者反應,溶液褪色;
③實驗4 中進行步驟②的目的驗證NO2-具有還原性,通過和實驗4步驟①進行對比,排除NO2-的存在對NO3-檢驗的干擾;
(4)實驗2除去溶液中H2O2,防止對后續實驗的干擾;實驗3檢驗NO2-的還原性,能使具有氧化性的紫紅色的酸性KMnO4 溶液褪色;實驗4①亞硝酸根離子無還原性;②通過和實驗4步驟①進行對比,排除NO2-的存在對NO3-檢驗的干擾,③說明既有亞硝酸根離子又有硝酸根離子.
解答 解:(1)NO2 與Na2O2 的反應,有兩種情況,假設一:生成NaNO3,反應的化學方程式為2NO2+Na2O2═2NaNO3,NO2能被Na2O2氧化生成NaNO3,假設二:生成NaNO2,NO2能被Na2O2還原,過氧化鈉中-1價的氧被二氧化氮中+4價的氮氧化成氧氣,氮元素被還原成+3價的氮,所以反應方程式為:2NO2+Na2O2═2NaNO2+O2,
故答案為:2NO2+Na2O2═2NaNO2+O2;
(2)①濃硝酸具有強氧化性,能和較不活潑金屬銅反應生成硝酸銅、二氧化氮和水,反應方程式為:Cu+4HNO3(濃)═Cu(NO3)2+2NO2↑+2H2O,
故答案為:Cu+4HNO3(濃)=Cu(NO3)2+2NO2↑+2H2O,
②不能根據“氣球變癟”的現象推斷假設一成立,理由是:根據方程式可以發現無論是按假設一2NO2+Na2O2═2NaNO3,二氧化氮為氣體,過氧化鈉、硝酸鈉為固體,體系的壓強減小,假設二2NO2+Na2O2═2NaNO2+O2,二氧化氮、氧氣為氣體,過氧化鈉、亞硝酸鈉為固體,體系的壓強減小,所以無論是按假設一還是假設二發生反應,都能觀察到“氣球變癟”的現象,
故答案為:不能根據“氣球變癟”的現象推斷假設一成立,理由是:根據方程式可以發現無論是按假設一還是假設二發生反應,體系的壓強都要減小,都能觀察到“氣球變癟”的現象;
(3)①過氧化氫在二氧化錳的催化作用下分解為水和氧氣,反應的方程式為:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,實驗2 的主要目的是排出溶液中H2O2對后續實驗的干擾,向其中加入少量MnO2粉末,待不再產生氣泡后,靜置后取上層清液即可,
故答案為:向其中加入少量MnO2粉末,待不再產生氣泡后,靜置后取上層清液;
②實驗3“產物含”NO2-,NO2-具有還原性,能使具有氧化性的紫紅色的酸性KMnO4 溶液褪色,
故答案為:KMnO4溶液褪色;
③實驗4步驟①滴入NaNO3溶液,無明顯變化,排除NO3-無還原性,加入濃硫酸后,2H++NO3-+Fe2+=NO2↑+Fe3++H2O,溶液變棕色,實驗4 中進行步驟②加入NaNO2溶液,立即變棕色,含NO3-的溶液遇 FeSO4和濃硫酸生成棕色物質[Fe(NO)]2-,通過和實驗4步驟①進行對比,排除NO2-的存在對NO3-檢驗的干擾,
故答案為:通過和實驗4步驟①進行對比,排除NO2-的存在對NO3-檢驗的干擾;
(4)實驗2向其中加入少量MnO2粉末,待不再產生氣泡后,靜置后取上層清液,除去溶液中H2O2,防止對后續實驗的干擾;實驗3利用高錳酸鉀的氧化性檢驗NO2-的還原性,若有,能使紫紅色的酸性KMnO4 溶液褪色;實驗4①亞硝酸根離子無還原性;②通過和實驗4步驟①進行對比,排除NO2-的存在對NO3-檢驗的干擾,③說明既有亞硝酸根離子又有硝酸根離子,
故答案為:Na2O2和NO2反應既能生成NaNO3也能生成NaNO2(或“假設一和假設二都成立”,或“Na2O2和NO2反應的產物中既含NO2-又含NO3-”).
點評 本題考查了探究Na2O2 和NO2產物的性質的實驗,根據實驗現象判斷物質具有的性質,掌握氮的化合物的性質是解答關鍵,題目難度中等.


科目:高中化學 來源: 題型:解答題
| 序號 | 實驗步驟 | 實驗現象 | 結論 |
| Ⅰ | 在兩個蒸發皿中各加入10mL冷水,控制相同燃燒條件,分別用乙醇和汽油作為燃料進行加熱,記錄從開始到水沸騰的時間. | 用乙醇加熱耗時118s;用汽油加熱耗時56s. | 猜想2不成立 (填“成立”或“不成立”) |
| Ⅱ | 實驗Ⅰ停止加熱后,取下蒸發皿,觀察蒸發皿的底部. | 用乙醇加熱的蒸發皿底部只有及少量炭黑,而用汽油加熱的蒸發皿底部有大量的炭黑. | 猜想1成立(可仿照上格填寫) |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 硫酸錳銨[(NH4)2SO4•MnSO4•nH2O]是淺粉色晶體,易溶于水,在農業上用作微量元素肥料.實驗室由MnO2制備硫酸錳銨的實驗步驟如下:
硫酸錳銨[(NH4)2SO4•MnSO4•nH2O]是淺粉色晶體,易溶于水,在農業上用作微量元素肥料.實驗室由MnO2制備硫酸錳銨的實驗步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在化學反應過程中,發生物質變化的同時一定發生能量變化 | |
| B. | 破壞生成物全部化學鍵所需要的能量大于破壞反應物全部化學鍵所需要的能量時,反應為吸熱反應 | |
| C. | 反應產物的總焓大于反應物的總焓時,反應吸熱,△H>0 | |
| D. | 熱化學方程式中反應熱數值的大小與化學方程式的計量數成比例 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 平衡時,其他條件不變,升高溫度可使該反應的平衡常數增大 | |
| B. | 平衡時,其他條件不變,增加 NH3 的濃度,廢氣中氮氧化物的轉化率減小 | |
| C. | 其他條件不變,使用高效催化劑,廢氣中氮氧化物的轉化率增大 | |
| D. | 單位時間內消耗 NO 和 N2 的物質的量比為 1:2 時,反應達到平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 升高溫度能加快反應速率的主要原因,是增加了反應物分子中活化分子的百分數 | |
| B. | 正反應是吸熱反應,達到平衡時,升高溫度,v正增大,v逆減小,所以平衡向正反應方向移動 | |
| C. | 一定條件下增大反應物的量,一定會加快反應速率 | |
| D. | 對于任何一個化學反應,用其中任何一種反應物濃度的減小來表示化學反應速率,都是相同的數值 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com