
分析 (1)先計算溶液中c(H+),再根據pH=-lgc(H+)計算溶液的pH;醋酸是弱電解質,在水溶液中部分電離;
(2)酸溶液中水電離出的c(H+)=$\frac{{K}_{w}}{c({H}^{+})}$;
(3)醋酸是弱電解質,在水溶液中部分電離;其電離平衡常數等于c(CH3COO-)、c(H+)之積與c(CH3COOH)的比;
(4)向丙中加入乙,會產生同離子效應而抑制丙電離;電離平衡常數只與溫度有關;
(5)NaCl是強酸強堿鹽,其水溶液呈中性,醋酸鈉是強堿弱酸鹽,其水溶液呈堿性,要使醋酸鈉溶液呈中性,醋酸應該稍微多些.
解答 解:(1)甲溶液中c(H+)=$\frac{{K}_{w}}{c(O{H}^{-})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,pH=-lgc(H+)=-lg10-13=13;
丙中醋酸是弱電解質,在水溶液中部分電離,所以氫離子濃度小于酸濃度,則該溶液中c(H+)<0.1mol/L,所以溶液的pH>1,
故答案為:13;>;
(2)酸溶液中水電離出的c(H+)=$\frac{{K}_{w}}{c({H}^{+})}$=$\frac{1{0}^{-14}}{0.1}$mol/L=10-13 mol/L,故答案為:10-13;
(3)醋酸是弱電解質,在水溶液中部分電離,其電離方程式為CH3COOH?H++CH3COO-;其電離平衡常數等于c(CH3COO-)、c(H+)之積與c(CH3COOH)的比,所以Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$,
故答案為:CH3COOH?H++CH3COO-;Ka=$\frac{c({H}^{+}).c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$;
(4)向丙中加入乙,乙電離出氫離子而導致溶液中c(H+)增大,會產生同離子效應而抑制丙電離,則抑制丙電離;電離平衡常數只與溫度有關,溫度不變,電離平衡常數不變,
故答案為:抑制;增大;不變;
(5)NaCl是強酸強堿鹽,其水溶液呈中性,醋酸鈉是強堿弱酸鹽,其水溶液呈堿性,要使醋酸鈉溶液呈中性,醋酸應該稍微多些,所以各取25mL的乙、丙兩溶液,分別用甲中和至pH=7,則消耗甲的體積大小關系為V(乙)>V (丙),且乙和甲的體積相等,故答案為:大于.
點評 本題考查弱電解質的電離及酸堿混合溶液定性判斷等知識點,為高頻考點,明確弱電解質電離特點及弱電解質電離影響因素是解本題關鍵,注意(4)中電離平衡常數只與溫度有關,與溶液酸堿性及濃度無關,題目難度不大.


科目:高中化學 來源: 題型:解答題
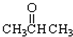 ③CH3CH2Br ④
③CH3CH2Br ④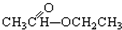 ⑤
⑤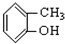 ⑥
⑥ ⑦
⑦ ⑧
⑧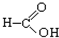 ⑨
⑨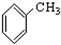 ⑩
⑩
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | K+、CO32-、NO3-、Cl- | B. | Na+,NH4+、Cl-,SO42- | ||
| C. | NH4+、K+、HCO3-、Cl- | D. | Na+、Ba2+、Br-、Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 容量瓶中原有少量蒸餾水 | |
| B. | 定容時觀察液面俯視 | |
| C. | 滴管加水時,有少量水滴到容量瓶外 | |
| D. | 溶液從燒杯轉移到容量瓶中后沒有洗滌燒杯 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 在配制前用稀硫酸潤洗容量瓶后,未用蒸餾水洗滌 | |
| B. | 定容搖勻后,發現液面低于刻度線,再加入蒸餾水至與刻度線相切 | |
| C. | 洗滌量筒,并將洗滌液轉入容量瓶 | |
| D. | 定容時仰視讀數. |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
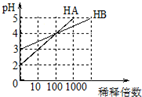
| A. | 向等體積等濃度的HA和HB溶液中滴加等濃度的NaOH溶液,至至溶液呈中性,HB消耗的NaOH多 | |
| B. | 加水稀釋HB酸溶液,則c(H+)/c(HB)減小 | |
| C. | 常溫下,用pH=a的V1L HA酸與pH=b的V2L NaOH溶液混合,若a+b=14,則反應后溶液呈中性 | |
| D. | 若向等體積等pH的HB和HA酸溶液加入足量鋅粉,均反應生成H2,最終HB生成的H2多 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①⑥ | B. | ③ | C. | ②⑤ | D. | ①④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 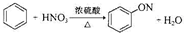 | |
| B. | H2C=CH2+Br2→CH3CHBr2 | |
| C. | CH3COOH+CH3CH2OH $→_{△}^{濃硫酸}$ CH3CH2OCH2CH3+H2O | |
| D. | CH4+2O2 $\stackrel{點燃}{→}$ CO2+2H2O |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com