
| A. | 92.37% | B. | 9.2% | C. | 50% | D. | 25% |
分析 m(CuSO4)=200g×10%=20g,用惰性電極電解硫酸銅溶液時(shí),陽(yáng)極反應(yīng)式為4OH--4e-═2H2O+O2↑,陰極電極反應(yīng)為Cu2++2e-=Cu,總反應(yīng)離子方程式為2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+4H++O2↑,根據(jù)方程式知得硫酸銅參加反應(yīng)的質(zhì)量=$\frac{\frac{0.16g}{32g/mol}}{1}×2×160g/mol$=1.6g,還剩余硫酸銅質(zhì)量=20g-1.6g=18.4g,根據(jù)質(zhì)量分?jǐn)?shù)公式計(jì)算電解后的溶液中硫酸銅質(zhì)量分?jǐn)?shù).
解答 解:m(CuSO4)=200g×10%=20g,用惰性電極電解硫酸銅溶液時(shí),陽(yáng)極反應(yīng)式為4OH--4e-═2H2O+O2↑,陰極電極反應(yīng)為Cu2++2e-=Cu,總反應(yīng)離子方程式為2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+4H++O2↑,根據(jù)方程式知得硫酸銅參加反應(yīng)的質(zhì)量=$\frac{\frac{0.16g}{32g/mol}}{1}×2×160g/mol$=1.6g,還剩余硫酸銅質(zhì)量=20g-1.6g=18.4g,電解后溶液中硫酸銅質(zhì)量分?jǐn)?shù)=$\frac{18.4g}{200g}×100%$=9.2%,故選B.
點(diǎn)評(píng) 本題以電解原理為載體考查質(zhì)量分?jǐn)?shù)有關(guān)計(jì)算,為高頻考點(diǎn),明確析出氧氣與硫酸銅的關(guān)系式是解本題關(guān)鍵,題目難度不大.



| 年級(jí) | 高中課程 | 年級(jí) | 初中課程 |
| 高一 | 高一免費(fèi)課程推薦! | 初一 | 初一免費(fèi)課程推薦! |
| 高二 | 高二免費(fèi)課程推薦! | 初二 | 初二免費(fèi)課程推薦! |
| 高三 | 高三免費(fèi)課程推薦! | 初三 | 初三免費(fèi)課程推薦! |
科目:高中化學(xué) 來(lái)源: 題型:解答題
| 元素 | 相關(guān)信息 |
| A | 原子核外L層電子數(shù)是K層的2倍 |
| B | 其一種單質(zhì)被稱(chēng)為地球生物的“保護(hù)傘” |
| C | 元素的第一電離能是第3周期所有元素中最小的 |
| D | 基態(tài)原子最外層電子排布為(n+1)sn(n+1)p(n+2) |
| E | 可形成多種氧化物,其中一種為具有磁性的黑色晶體 |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題

查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
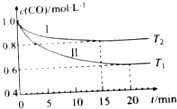 為了減少CO對(duì)大氣的污染,某科研小組在一個(gè)體積為1L的容積不變的密閉容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反應(yīng)轉(zhuǎn)化為綠色能源H2,不同溫度下,CO的濃度[c(CO)]隨時(shí)間[t]變化的曲線(xiàn)如圖所示.
為了減少CO對(duì)大氣的污染,某科研小組在一個(gè)體積為1L的容積不變的密閉容器中充入等量的CO和H2O(g),研究用CO和H2O(g)反應(yīng)轉(zhuǎn)化為綠色能源H2,不同溫度下,CO的濃度[c(CO)]隨時(shí)間[t]變化的曲線(xiàn)如圖所示.查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
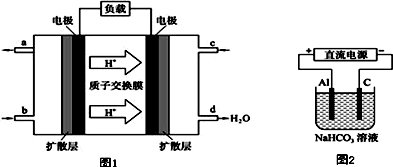
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:填空題
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:解答題
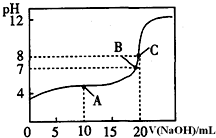 (1)pH=13的CH3COONa溶液加水稀釋100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根離子水解溶液顯堿性,CH3COO-+H2O?CH3COOH+OH-,加水稀釋后醋酸根離子的水解程度增大,氫氧根離子濃度略有增大,則溶液的pH>11(用離子方程式和必要的文字說(shuō)明);pH相等的NaOH溶液與CH3COONa溶液,分別加熱到相同的溫度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);
(1)pH=13的CH3COONa溶液加水稀釋100倍后,pH>11(填“>”“=”或“<”),原因是醋酸根離子水解溶液顯堿性,CH3COO-+H2O?CH3COOH+OH-,加水稀釋后醋酸根離子的水解程度增大,氫氧根離子濃度略有增大,則溶液的pH>11(用離子方程式和必要的文字說(shuō)明);pH相等的NaOH溶液與CH3COONa溶液,分別加熱到相同的溫度后CH3COONa溶液的pH>NaOH溶液的pH(填“>”“=”或“<”);查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 鋁粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| B. | 過(guò)量Ba(OH)2溶液與少量的NaHCO3溶液混合Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| C. | 石英溶于NaOH溶液:Si4++2O2-+2OH-=SiO32-+H2O | |
| D. | 硅酸鈉溶液中滴加鹽酸:SiO32-+2H+═H2SiO3↓ |
查看答案和解析>>
科目:高中化學(xué) 來(lái)源: 題型:選擇題
| A. | 0.1mol/LCH3COOH溶液加水稀釋?zhuān)芤褐衏(OH-)增大 | |
| B. | 將NaOH和氨水溶液各稀釋一倍,兩者的OH-濃度均減少到原來(lái)的$\frac{1}{2}$ | |
| C. | 相同濃度的HCl和CH3COOH,兩溶液中c(H+)相同 | |
| D. | 甲溶液的pH是5,乙溶液的pH是4,則甲溶液與乙溶液的中c(H+)之比為10:1 |
查看答案和解析>>
百度致信 - 練習(xí)冊(cè)列表 - 試題列表
湖北省互聯(lián)網(wǎng)違法和不良信息舉報(bào)平臺(tái) | 網(wǎng)上有害信息舉報(bào)專(zhuān)區(qū) | 電信詐騙舉報(bào)專(zhuān)區(qū) | 涉歷史虛無(wú)主義有害信息舉報(bào)專(zhuān)區(qū) | 涉企侵權(quán)舉報(bào)專(zhuān)區(qū)
違法和不良信息舉報(bào)電話(huà):027-86699610 舉報(bào)郵箱:58377363@163.com