
分析 I.依據氯氣與水反應生成產物的性質判斷解答:
Ⅱ.(1)氯氣和氫氧化鈉反應生成NaCl、NaClO、水;
(2)依據方程式Cl2+2NaOH=NaCl+NaClO+H2O及物質的量計算解答;
(3)①依據配制一定物質的量濃度溶液一般步驟選擇需要儀器;
②依據配制一定物質的量濃度溶液一般步驟排序;
③依據m=CVM計算需要溶質的質量;
④分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行誤差分析.
解答 解:I.氯氣溶液水生成鹽酸和次氯酸,使溶液呈酸性,紫色石蕊溶液遇到酸顯紅色,生成的次氯酸具有漂白性,能夠使變紅的石蕊褪色,所以看到現象為:溶液變為紅色,然后褪色;
故答案為:溶液變為紅色,然后褪色;氯氣溶液水生成鹽酸和次氯酸,使溶液呈酸性,紫色石蕊溶液遇到酸顯紅色,生成的次氯酸具有漂白性,能夠使變紅的石蕊褪色;
Ⅱ.(1)氯氣和氫氧化鈉反應生成NaCl、NaClO、水,離子方程式:Cl2+2OH-═Cl-+ClO-+H2O;
故答案為:Cl2+2OH-═Cl-+ClO-+H2O;
(2)n(Cl2)=$\frac{2.24L}{22.4L/mol}$=0.1mol
由Cl2+2NaOH=NaCl+NaClO+H2O
知n(NaOH)=2n(Cl2)=2×0.1mol=0.2mol
V(NaOH溶液)=$\frac{0.2L}{4.0mol/L}$=0.05L,
故答案為:0.05;
(3)①配制一定物質的量濃度溶液一般步驟:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻等用到的儀器:燒杯、玻璃棒、100mL容量瓶、膠頭滴管,用不到的儀器:錐形瓶;
故答案為:D;
②配制一定物質的量濃度溶液一般步驟:計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻,正確的操作步驟為:abdcfe;
故答案為:abdcfe;
③配制100mL4.0mol•L-1NaOH溶液,需要氫氧化鈉的質量m=0.1L×4.0mol/L×40g/mol=16.0g;
故答案為:16.0;
④A.沒有洗滌燒杯和玻璃棒,導致溶質的物質的量偏小,溶液濃度偏低,故A不選;
B.如果加水超過了刻度線,取出水使液面恰好到刻度線,導致溶質的物質的量偏小,溶液濃度偏低,故B不選;
C.容量瓶沒有干燥,對溶質的物質的量和溶液體積的不產生影響,溶液濃度不準確,故C選;
故選:C.
點評 本題考查了元素化合物性質及一定物質的量濃度溶液的配制,明確氯氣的性質是解題關鍵,題目難度不大.


 備戰中考寒假系列答案
備戰中考寒假系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 11:3 | B. | 2:3 | C. | 10:3 | D. | 3:4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②③④ | B. | ①②③⑤ | C. | ①②③ | D. | ②③④ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用品紅溶液鑒別CO2和SO2 | |
| B. | 用濕潤的pH試紙測稀堿液的pH | |
| C. | 用NaOH溶液液鑒別MgCl2和AlCl3溶液 | |
| D. | 用焰色反應鑒別NaCl和KCl |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
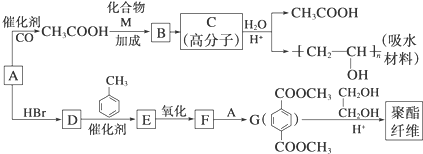
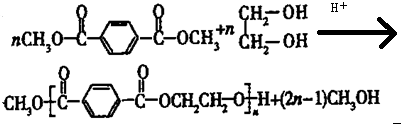 .
.查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 沸點不同的液體可用蒸餾的方法分離 | |
| B. | 易溶與難溶的固體混合物可用溶解、過濾、蒸發、結晶的方法分離 | |
| C. | 用酒精可以從碘水中萃取碘 | |
| D. | 汽油和水的化合物不可以用分液漏斗分離 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com