
| A. | c(H+) | B. | Ka | ||
| C. | c(OH-) | D. | $\frac{c(C{H}_{3}COOH)}{c(C{H}_{3}CO{O}^{-})}$ |
分析 醋酸為弱酸,稀釋過程中醋酸的電離程度增大,溶液中氫離子、醋酸根離子的物質的量增大,醋酸的物質的量減小,由于溶液體積變化程度更大,則溶液中氫離子、醋酸根離子、醋酸的濃度減小;由于水的離子積不變,則溶液中氫氧根離子濃度增大,據此進行解答.
解答 解:A.因CH3COOH為弱酸,則濃度為0.1mol•L-1CH3COOH溶液加水不斷稀釋,促進電離,平衡正向移動,電離程度增大,n(H+)增大,但c(H+)不斷減小,故A錯誤;
B.因電離平衡常數只與溫度有關,則Ka(CH3COOH)在稀釋過程中不變,故B錯誤;
C.溶液中c(H+)•c(OH-)之積為水的離子積,稀釋后氫離子濃度減小,氫氧根離子濃度增大,故C正確;
D.稀釋過程中,醋酸的電離程度增大,則溶液中的氫離子的物質的量增大、醋酸的物質的量減小,醋酸根離子物質的量增大,由于在同一溶液中,則醋酸與醋酸根離子的濃度的比值減小,故D錯誤;
故選C.
點評 本題考查了弱電解質的電離平衡及其影響,題目難度中等,注意掌握弱電解質在溶液中的電離平衡及其影響因素,明確醋酸稀釋過程中氫離子濃度和氫氧根離子濃度乘積不變.


 天天練口算系列答案
天天練口算系列答案科目:高中化學 來源: 題型:選擇題
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 0.02mol/L的NaOH溶液與0.04mol/L的NaHC2O4溶液等體積混合液:2c(OH-)+c(C2O42-)=c(HC2O4)+2c(H+) | |
| C. | 疊氨酸(NH3)與醋酸酸性相近,0.1mol•L-1 NaN3水溶液中離子濃度大小順序為:c(Na+)>c(N3-)>c(OH-)>c(H+) | |
| D. | 向氨水中逐滴滴入鹽酸至溶液的pH=7,則混合液中:c(NH4+)=c(Cl-) |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
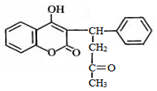
| A. | 分子中有1個手性碳原子 | B. | 遇FeCl3溶液顯紫色 | ||
| C. | 1mol殺鼠靈最多能與9molH2反應 | D. | 能發生加成、取代、氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液:Ca2+、Na+、Cl-、HCO3- | |
| B. | 能使pH試紙呈紅色的溶液:Na+、NH4+、I-、NO3- | |
| C. | 水電離出的c(H+)=10-13mol•L-1的溶液中:K+、Na+、SO42-、ClO- | |
| D. | 有較多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用鉑絲蘸取某未知溶液于酒精燈火焰上灼燒,火焰顯黃色,證明該溶液中不含K+ | |
| B. | 向某未知溶液中先滴加氯水,再滴加KSCN溶液,出現血紅色,證明溶液中含有Fe2+ | |
| C. | 萃取碘水中的碘時,可以選擇苯或四氧化碳作為萃取劑 | |
| D. | 某無色溶液中加入硝酸銀溶液后產生白色沉淀,再加入稀鹽酸沉淀不消失,證明原溶液中含有Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 序號 | ① | ② | ③ |
| 溶液 | NaClO | NaHCO3 | Na2CO3 |
| pH | 10.3 | 8.3 | 11.6 |
| A. | 酸性:HClO>H2CO3 | |
| B. | 由水電離產生的c(OH-):①>② | |
| C. | 溶液①中的c(ClO-)大于溶液②中的c(HCO3-) | |
| D. | 溶液③中:c(HCO3-)+c(CO32-)=0.1 mol•L-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉和水反應放熱 | B. | 金屬鈉和水反應產生可燃燒的氫氣 | ||
| C. | 可在現場使用干沙滅火 | D. | 可在現場使用高壓水槍滅火 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
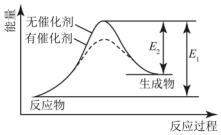
| A. | 該反應為放熱反應 | B. | 催化劑改變了化學反應的熱效應 | ||
| C. | 催化劑不改變化學反應歷程 | D. | 催化劑改變了化學反應歷程 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com