
| A. | -定量的Fe與含1molHNO3,的稀硝酸恰好反應,被還原的氮原子數小于NA | |
| B. | 1mol A1Cl3在熔融時離子總數為0.4NA | |
| C. | 常溫常壓下,等質量的S02、S2含有相同的分子數 | |
| D. | 125g CuS04•5H20 品體中含有0.5NA個Cu2+ |
分析 A、硝酸與鐵反應時,硝酸既做氧化劑又做酸;
B、氯化鋁為共價化合物;
C、S02、S2的摩爾質量相同;
D、求出五水硫酸銅的物質的量,然后根據1mol五水硫酸銅中含1mol銅離子來分析.
解答 解:A、硝酸與鐵反應時,硝酸既做氧化劑又做酸,故當硝酸共1mol時,被還原的硝酸一定小于1mol,即被還原的氮原子數小于NA個,故A正確;
B、氯化鋁為共價化合物,而共價鍵在熔融時不能電離,故1mol氯化鋁在熔融時無離子,故B錯誤;
C、S02、S2的摩爾質量相同,故等質量的兩者的物質的量相同,則分子個數相同,故C正確;
D、125g五水硫酸銅的物質的量為0.5mol,而1mol五水硫酸銅中含1mol銅離子,故0.5mol五水硫酸銅中含0.5mol銅離子即0.5NA個,故D正確.
故選B.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


科目:高中化學 來源: 題型:選擇題

| A. | A2(g)+B2(g)=2AB(g)△H<0 | |
| B. | 每生成2分子AB放出bkJ熱量 | |
| C. | 該反應中反應物的總能量低于生成物的總能量 | |
| D. | 斷裂1molA-A鍵吸收akJ能量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鐵跟稀硫酸反應:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 鐵跟FeCl3溶液反應:Fe+Fe3+═2Fe2+ | |
| C. | 鈉和冷水反應:2Na+2H2O=═2Na++2OH-+H2↑ | |
| D. | FeCl2溶液跟Cl2反應:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 等物質的量的硫蒸氣和硫固體分別完全燃燒,后者放出熱量多 | |
| B. | 含1 mol CH3COOH的稀溶液與含1 mol NaOH的稀溶液混合,放出的熱量小于57.3 kJ | |
| C. | 由C(石墨)=C(金剛石);△H=+1.90 kJ/mol可知,金剛石比石墨穩定 | |
| D. | 能自發進行的反應一定是放熱反應,不能自發進行的反應一定是吸熱反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
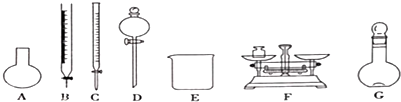
| A. | 需要稱量NaClO固體的質量為144.0g | |
| B. | 定容搖勻后,若溶液液面低于容量瓶刻度線.不必再加水定容 | |
| C. | 除從如圖所示的儀器中選擇需要的以外.還-種玻填儀器 | |
| D. | 容量瓶用蒸餾水洗凈后應烘干才能用于溶液配制.否則結果偏低 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
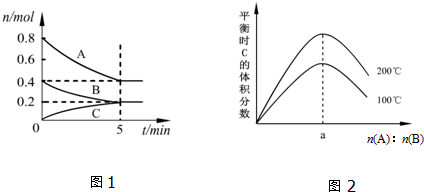
| A. | 200℃時,反應從開始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 圖2所知反應xA(g)+yB(g)?zC(g)的△H>0,且a=2 | |
| C. | 若在圖1所示的平衡狀態下,再向體系中充入He,此時v正>v逆 | |
| D. | 200℃時,向容器中充入1.6molA和0.8molB,達到平衡時,A的轉化率大于50% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 高鐵酸鹽(含FeO42-離子)是新型、高效、多功能水處理劑,既能消毒殺菌又能凈水 | |
| B. | 用硫酸清洗鍋爐中的水垢 | |
| C. | 為防止電池中的重金屬等污染土壤和水體,應積極開發廢電池的綜合利用技術 | |
| D. | 使用Na2S作沉淀劑,可有效除去廢水中Cu2+和Hg2+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com