
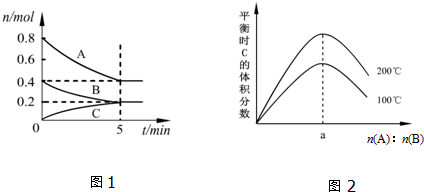
| A. | 200℃時,反應從開始到平衡的平均速率v(B)=0.04 mol•L-1•min-1 | |
| B. | 圖2所知反應xA(g)+yB(g)?zC(g)的△H>0,且a=2 | |
| C. | 若在圖1所示的平衡狀態下,再向體系中充入He,此時v正>v逆 | |
| D. | 200℃時,向容器中充入1.6molA和0.8molB,達到平衡時,A的轉化率大于50% |
分析 A.由圖Ⅰ可知,200℃時平衡時,B的物質的量變化量為0.4mol-0.2mol=0.2mol,根據v=$\frac{\frac{△n}{V}}{△t}$計算v(B);
B.由圖Ⅱ可知,n(A):n(B)一定時,溫度越高平衡時C的體積分數越大,說明升高溫度平衡向正反應移動,據此判斷反應熱效應;
在一定的溫度下只要A、B起始物質的量之比剛好等于平衡化學方程式化學計量數之比,平衡時生成物C的體積分數就最大,由圖Ⅰ判斷200℃時A、B的起始物質的量,據此計算a的值;
C.恒溫恒容條件下,通入氦氣反應混合物的濃度不變,平衡不移;
D.由圖1可知,達到平衡時,A的轉化率為50%,200℃時,向容器中充入1.6mol A 和0.8 mol B達到平衡等效為在原平衡基礎上增大壓強,根據圖Ⅰ中A、B、C的物質的量變化量之比等于化學計量數之比確定x、y、z,據此判斷增大壓強平衡移動方向.
解答 解:A.由圖Ⅰ可知,200℃時5min達到平衡,平衡時B的物質的量變化量為0.4mol-0.2mol=0.2mol,故v(B)=$\frac{\frac{0.2mol}{2L}}{5min}$=0.02 mol•L-1•min-1,故A錯誤;
B.由圖Ⅱ可知,n(A):n(B)一定時,溫度越高平衡時C的體積分數越大,說明升高溫度平衡向正反應移動,升高溫度平衡向吸熱反應移動,故正反應為吸熱反應,即△H>0;圖Ⅰ可知,200℃時平衡時,A的物質的量變化量為0.8mol-0.4mol=0.4mol,B的物質的量變化量為0.2mol,在一定的溫度下只要A、B起始物質的量之比剛好等于平衡化學方程式化學計量數之比,平衡時生成物C的體積分數就最大,A、B的起始物質的量之比=0.4mol:0.2mol=2,即a=2,故B正確;
C.恒溫恒容條件下,通入氦氣,反應混合物各組分的濃度不變,平衡不移動,故v(正)=v(逆),故C錯誤;
D.由圖Ⅰ可知,200℃時平衡時,A、B、C的物質的量變化量分別為0.4mol、0.2mol、0.2mol,物質的量之比等于化學計量數之比,故x:y:z=0.4mol:0.2mol:0.2mol=2:1:1,達到平衡時A的轉化率為$\frac{0.8mol-0.4mol}{0.8mol}$=50%,200℃時,向容器中充入1.6mol A 和0.8 mol B達到平衡等效為在原平衡基礎上增大壓強,平衡向正反應移動,故達到平衡時A的轉化率大于50%,故D正確;
故選BD.
點評 本題考查化學平衡圖象、反應速率計算、影響化學平衡的因素、化學平衡有關計算等,難度中等,注意C選項中理解稀有氣體對化學平衡移動的影響.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化學 來源: 題型:選擇題
| A. | 只有② | B. | 只有②③ | C. | 只有①② | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | -定量的Fe與含1molHNO3,的稀硝酸恰好反應,被還原的氮原子數小于NA | |
| B. | 1mol A1Cl3在熔融時離子總數為0.4NA | |
| C. | 常溫常壓下,等質量的S02、S2含有相同的分子數 | |
| D. | 125g CuS04•5H20 品體中含有0.5NA個Cu2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
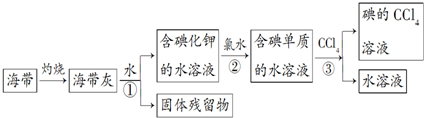
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 乙醇汽油是被廣泛使用的新型清潔燃料,工業生產乙醇的一種反應原理為:
乙醇汽油是被廣泛使用的新型清潔燃料,工業生產乙醇的一種反應原理為:| 溫度/℃ | 800 | 1000 | 1200 | 1400 |
| 平衡常數 | 0.45 | 1.92 | 276.5 | 1771.5 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用食醋除去暖水瓶中的薄層水垢 | B. | 石油的分餾和煤的干餾 | ||
| C. | 用二氧化氯(ClO2)為自來水消毒 | D. | 液氨作制冷劑 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com