
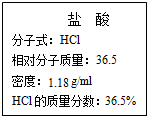
 如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:
如圖為實驗室某濃鹽酸試劑瓶標簽上的有關數據,試根據標簽上的有關數據回答下列問題:分析 (1)依據C=$\frac{1000ρω}{M}$計算濃鹽酸的物質的量濃度;
(2)根據該物理量是否有溶液的體積有關判斷;
(3)配制450mL物質的量濃度為0.4mol•L-1的稀鹽酸,應選擇500mL容量瓶,依據溶液稀釋過程中溶質的物質的量不變計算需要濃鹽酸的體積;分析操作對溶質的物質的量和溶液體積的影響,依據C=$\frac{n}{V}$進行誤差分析;
(4)100mL 0.4mol•L-1的鹽酸中HCl的物質的量n=CV=0.4mol/L×0.1L=0.04mol,100mL 0.1mol•L-1的AgNO3溶液中AgNO3的物質的量n=CV=0.1mol/L×0.1L=0.01mol,兩者混合后發生反應:Ag++Cl-=AgCl↓,根據兩者的量來分析Cl-的濃度.
解答 解:(1)質量分數36.5%,密度為1.18g/mL的鹽酸的物質的量濃度C=$\frac{1000×1.18×36.5%}{36.5}$=11.8mol/L;
故答案為:11.8;
(2)A.溶液中HCl的物質的量=nV,所以與溶液的體積有關,故A不選;
B.溶液具有均一性,溶液濃度與溶液的體積無關,故B選;
C.溶液中Cl-的數目=nNA=CVNA,所以與溶液的體積有關,故c不選;
D.溶液的密度與溶液的體積無關,故D選;
故選BD;
(3)配制450mL物質的量濃度為0.4mol•L-1的稀鹽酸,應選擇500mL容量瓶,設需要濃鹽酸體積為V,則依據溶液稀釋規律,V×11.8mol/L=0.4mol/L×500mL,解得V=16.9mL;
若用量筒量取濃鹽酸時俯視觀察凹液面,導致量取的濃鹽酸體積偏小,氯化氫的物質的量偏小,溶液濃度偏低;若定容搖勻后發現液面低于刻度線,又補加水至刻度線,導致溶液體積偏大,溶液濃度偏低,
故答案為:16.9;偏低;偏低;
(4)100mL 0.4mol•L-1的鹽酸中HCl的物質的量n=CV=0.4mol/L×0.1L=0.04mol,100mL 0.1mol•L-1的AgNO3溶液中AgNO3的物質的量n=CV=0.1mol/L×0.1L=0.01mol.
根據兩者混合后發生反應:Ag++Cl-=AgCl↓可知,HCl過量,故反應后溶液中的n(Cl-)=0.04mol-0.01mol=0.03mol,故反應后的濃度c(Cl-)=$\frac{0.03mol}{0.2L}$=0.15mol/L,
故答案為:0.15mol/L.
點評 本題考查了一定物質的量濃度溶液的配制,明確配制原理和操作步驟是解題關鍵,注意誤差分析的方法和技巧,題目難度不大.


 通城學典默寫能手系列答案
通城學典默寫能手系列答案 金牌教輔培優優選卷期末沖刺100分系列答案
金牌教輔培優優選卷期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | ①④⑥ | B. | ②③⑤⑥ | C. | ②④⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 將 CO2 通入次氯酸鈣溶液可生成次氯酸 | |
| B. | 鈉在氧氣中燃燒主要生成Na2O | |
| C. | Na2O、Na2O2 組成元素相同,與 CO2 反應產物也相同 | |
| D. | 新制氯水顯酸性,向其中滴加少量紫色石蕊試液,充分振蕩后溶液呈紅色 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 離子的還原性強弱:Fe2+>Br->Cl- | |
| B. | 當氯氣少量時,發生的離子反應:2Fe2++Cl2═2Fe3++2Cl- | |
| C. | 當a=b時,反應后溶液的離子濃度:c(Fe3+):c(Br-):c(Cl-)=1:2:2 | |
| D. | 當氯氣過量時,發生離子反應:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 乙烯通入酸性高錳酸鉀溶液中 | |
| B. | 光照射甲烷與氯氣的混合氣體 | |
| C. | 在鎳作催化劑的條件下,苯與氫氣反應 | |
| D. | 苯與液溴混合后撒入鐵粉 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①② | B. | ①②③ | C. | ②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | (1)(4)(5) | B. | (2)(5) | C. | (1)(3) | D. | (2)(3)(5) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com