
 很多金屬、非金屬及其化合物在科學研究和工業生產中都有重要用途.回答下列有關問題:
很多金屬、非金屬及其化合物在科學研究和工業生產中都有重要用途.回答下列有關問題:分析 (1)Cr是24號元素,其原子核外有24個電子,根據構造原理寫出基態Cr原子核外電子排布式;Cr原子有6個未成對電子,短周期元素中基態原子未成對電子數為Cr的一半的元素有N、P,同主族,元素的電負性隨著原子序數的增大而減小;
(2)根據氮的價層電子對數判斷;N最外層有5個電子,與一個氧形成雙鍵用去2個電子,與另一個氧形成單鍵用去1個電子,還剩下兩個電子,提供給第三個氧做為共用電子對,使氮和氧達到8電子穩定結構,從而形成配位鍵;尿素分子間存在氫鍵,使其熔沸點升高;
(3)Ni(CO)4中配體是CO,CO的等電子體是與其原子個數相等且價電子數相等的分子或離子;
(4)利用均攤法計算該晶胞中含有的銅原子和氫原子個數,再根據質量、密度和體積之間的關系式計算,設晶胞的邊長為a,a=$\root{3}{\frac{4×65}{ρ{N}_{A}}}$,再根據晶胞中Cu原子與H原子之間的最短距離為體對角線的$\frac{1}{4}$,據此答題.
解答 解:(1)Cr是24號元素,其原子核外有24個電子,根據能量最低原理可寫出電子排布式為1s22s22p63s23p63d54s1,Cr原子有6個未成對電子,短周期元素中基態原子未成對電子數為Cr的一半的元素有N、P,同主族,元素的電負性隨著原子序數的增大而減小,則電負性N大于P;
故答案為:1s22s22p63s23p63d54s1;N;
(2)硝酸中氮原子含有三個成鍵電子對,沒有孤電子對,則N原子的價層電子對數為3,屬于sp2;N最外層有5個電子,與一個氧形成雙鍵用去2個電子,與另一個氧形成單鍵用去1個電子,還剩下兩個電子,提供給第三個氧做為共用電子對,使氮和氧達到8電子穩定結構,從而形成配位鍵,即硝酸中含有一個配位鍵;尿素分子間存在氫鍵,使其熔沸點升高,而硝酸分子內存在氫鍵,使其熔沸點降低,所以尿素的熔沸點高于硝酸;
故答案為:sp2;1;尿素分子間存在氫鍵,使其熔沸點升高,而硝酸分子內存在氫鍵,使其熔沸點降低;
(3)CO分子中含有2個原子,其價電子個數是10,所以與Ni(CO)4中配體互為等電子的離子是CN-、C22-,
故答案為:CN-或C22-;
(4)該晶胞中含有4個H原子,銅原子個數=8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,所以該晶胞中含有4個銅原子4個氫原子,設該晶胞的邊長為a,則a=$\root{3}{\frac{4×65}{ρ{N}_{A}}}$,再根據晶胞中Cu原子與H原子之間的最短距離為體對角線的$\frac{1}{4}$,而體對角線為$\sqrt{3}$a,所以Cu原子與H原子之間的最短距離為$\frac{\sqrt{3}}{4}$×$\root{3}{\frac{4×65}{ρ{N}_{A}}}$=$\frac{\sqrt{3}}{4}\root{3}{\frac{260}{ρ•{N}_{A}}}$cm,
故答案為:$\frac{\sqrt{3}}{4}\root{3}{\frac{260}{ρ•{N}_{A}}}$.
點評 本題考查較為綜合,涉及晶胞的計算、價電子排布式的書寫、等電子體等知識點,晶胞的計算是學習難點,應熟練掌握,題目難度較大.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源:2016-2017學年河北石家莊辛集中學高二上階段考一化學卷(解析版) 題型:選擇題
某溫度下,相同pH的硫酸和硫酸鋁溶液中由水電離出的c(H+)分別是1.0×l0-10 mol•L-1和1.0×10-3 mol•L-1,則此溫度下水的離子積Kw為( )
A.1.0×l0-15 B.1.0×10-14 C.1.0×10-13 D.1.0×l0-7
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省長春市高三上學期期中考試化學試卷(解析版) 題型:選擇題
500mLKNO3和Cu(NO3)2的混合溶液中c(NO3-)為6.0mol•L-1,用石墨電極電解此溶液,當通電一段時間后,兩極均收到22.4L氣體(標準狀況),假定電解后溶液體積仍為500mL,下列說法正確的是
A.原混合溶液中c(K+)為4mol/L
B.電解后加入1molCu(OH)2可使溶液復原
C.電解后溶液中c(H+)為8mol/L
D.原溶液中c(Cu2+)為1mol/L
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省長春市高三上學期期中考試化學試卷(解析版) 題型:選擇題
化學已滲透到人類生活的各個方面,下列說法的錯誤是
A.交警檢查司機是否酒后駕車的原理中體現了乙醇的還原性
B.14C可用于文物年代的鑒定,14C與12C互為同位素
C.銅的金屬活動性比鐵的差,可在海輪外殼上裝若干銅塊以減緩其腐蝕
D.以石油、煤和天然氣為原料通過聚合反應可以獲得用途廣泛的高分子合成材料
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
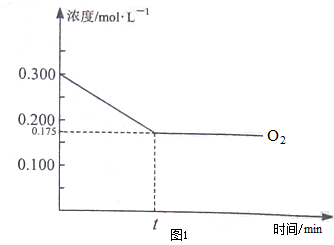

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
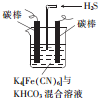 鐵及其化合物在日常生活中應用廣泛.
鐵及其化合物在日常生活中應用廣泛.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗操作 | 實驗現象 | 解釋或結論 | |
| A | 加熱(170℃)乙醇與濃硫酸混合物,將產生的氣體直接通入酸性高錳酸鉀溶液 | 酸性高錳酸鉀溶液紫紅色逐漸變淺 | 可能產生了SO2氣體 |
| B | 取少量KI溶液,先滴加氯水,再加入少量苯,振蕩、靜置 | 溶液分為兩層,下層是紫紅色 | KI和氯水及苯發生反應 |
| C | 將少量SO2通入苯酚鈉溶液中,振蕩 | 溶液中出現渾濁 | 因為發生了反應: C6H5O-+SO2+H2O═C6H5OH+HSO3- |
| D | 把濃氨水加入到盛有Cu2O的試管中 | 溶液先無色,靜置一段時間后變成藍色 | Cu+被空氣氧化成了Cu2+、使溶液顯藍色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Be原子的結構示意圖: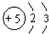 | |
| B. | 二氧化硅的分子式:SiO2 | |
| C. | 質子數為53、中子數為78的碘原子可表示為:53131I | |
| D. | 乙烯的結構式:CH2=CH2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com