
| A. | 已知2C(s)+O2(g)═2CO(g)△H=-221kJ/mol,則C的燃燒熱為110.5kJ/mol | |
| B. | 已知C(石墨,s)=C(金剛石,s)△H>0,則金剛石比石墨穩定 | |
| C. | 含20.0gNaOH的稀溶液與稀鹽酸完全中和,放出28.7kJ的熱量,則表示該反應中和熱的熱化學方程式為NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol | |
| D. | 已知:C(s)+O2(g)=CO2(g)△H1 C(s)+$\frac{1}{2}$O2(g)=CO (g)△H2,則△H1>△H2 |
分析 A.燃燒熱是指1mol純凈物完全燃燒生成穩定的氧化物放出的熱量,表示燃燒熱的熱化學方程式中可燃物為1mol,產物為穩定氧化物以此解答;
B、物質能量越高越活潑分析;
C、從中和熱的定義來判斷,中和熱的熱化學方程式必須讓生成的水為1mol;
D、比較反應熱的大小時要帶著正負號比較.
解答 解:A.碳的燃燒熱是指1mol碳完全燃燒生成的穩定的氧化物CO2放出的熱量,從2C(s)+O2(g)=2CO(g)△H=-221kJ/mol可知1mol碳燃燒生成CO放出110.5 kJ,故△H=-110.5 kJ/mol不是碳的燃燒熱,故A錯誤;
B、已知C(石墨,s)=C(金剛石,s)△H>0,反應是吸熱反應,金剛石能量高于石墨,則金剛石比石墨活潑,故B錯誤;
C、在稀溶液中,酸跟堿發生中和反應生成1 mol水時的反應熱叫做中和熱中和熱.20.0gNaOH的物質的量n=$\frac{m}{M}$=$\frac{20g}{40g/mol}$=0.5nol,與稀鹽酸完全中和生成0.5mol水,此時放出熱量28.7kJ,故當生成1mol水時放熱57.4KJ,故該反應中和熱的熱化學方程式為:NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4kJ/mol,故C正確;
D、反應 C(s)+O2(g)═CO2(g)△H1 ①和反應 C(s)+1/2 O2(g)═CO(g)△H2 ②均為放熱反應,△H均小于0,由于反應①是碳的完全燃燒,②是碳的不完全燃燒,故①放出的熱量多于②,則△H1<△H2.故D錯誤;
故選C.
點評 本題考查了燃燒熱、中和熱的概念分析理解,掌握熱化學方程式的意義是解答本題的關鍵,題目較簡單.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
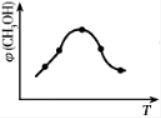
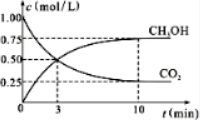
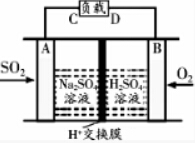
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g);△H=-241.8 kJ•mol-1,則氫氣的燃燒熱為241.8 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金剛石,s);△H=+1.9 kJ•mol-1,則石墨比金剛石穩定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l);△H=-57.3 kJ•mol-1,則含1mol NaOH的稀溶液與1mol的稀醋酸完全中和,放出的熱量也等于57.3kJ | |
| D. | 已知2C(s)+2O2(g)═2CO2(g))△H=a kJ•mol-1、2C(s)+O2(g)═2CO(g)△H=b kJ•mol-1,則a>b |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 427℃時該反應的平衡常數為9.4,則該反應的△H>0 | |
| B. | 800℃下,該反應的化學平衡常數為0.25 | |
| C. | 同溫下,若繼續向該平衡體系中通入1.0mol的H2O(g),則平衡時H2O(g)轉化率為66.7% | |
| D. | 同溫下,若繼續向該平衡體系中通入1.0mol的CO(g),則平衡時H2O(g)物質的量分數為11.1% |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na+、OH一、HCO3- Cu2+ | B. | NH4+、NO3-、OH-、K+ | ||
| C. | H+、K+、CO32-、SO42- | D. | Ba2+、OH一、C1-、Na+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com