
【題目】一定溫度下,在2.5L的恒容密閉容器中發生如下反應:CO2(g)+H2S(g)![]() COS(g)+H2O(g)
COS(g)+H2O(g)
實驗 | 溫度/K | 起始物質的量/mol | 平衡物質的量/mol | 平衡常數 | |
CO2 | H2S | H2O | |||
I | 607 | 0.11 | 0.41 | 0.01 | |
II | 607 | 0.22 | 0.82 | ||
III | 620 | 0.1 | 0.4 | 6.74×10-3 | |
下列說法不正確的是( )
A. 該反應正反應為吸熱反應
B. 607K時,把物質的量均為0.1mol四種反應物加入該反應器中,反應將向正反應方向進行
C. 實驗Ⅱ達到平衡時容器中COS的物質的量為0.02mol
D. 實驗Ⅲ中,無論是開始還是至化學平衡狀態,混合氣體的密度始終不變
【答案】B
【解析】試題分析:A、CO2(g)+H2S(g)![]() COS(g)+H2O(g),在反應開始中n(CO2)= 0.11mol;n(H2S)=0.41mol; n(H2O)=0;在反應過程中水改變的物質的量是n(H2O)=0.01mol,則根據方程式的系數關系可知,n(CO2)= n(COS)= n(H2S)= n(H2O)=0.01mol。所以平衡時各種物質的物質的量分別是n(CO2)=0.1mol,n(H2S)= 0.4mol;n(COS)= n(H2O)=0.01mol,由于反應前后系數和相等,所以此時K= [c(COS)·c(H2O)] ÷[c(CO2)· c(H2S)] ="(0.01×0.01)÷(0.1×0.4)" =0.0025<6.74×10-3 ,溫度升高,K增大,說明升高溫度,化學平衡向正反應方向移動。根據平衡移動原理,升高溫度,化學平衡向吸熱反應方向移動,所以該反應的正反應是吸熱反應,A正確; B、根據選項A分析可知607K時該反應的平衡常數為K=2.50×10-3 ,若把物質的量均為0.1mol四種反應物加入該反應器中,則Qc=(0.1×0.1)÷(0.1×0.1)=1>0.0025,所以反應逆向進行,V逆>V正,B錯誤;C、該反應是反應前后氣體體積相等的反應,增大壓強,化學平衡不發生移動,所以達到平衡時容器中COS的物質的量為0.02mol,C正確;D、實驗Ⅲ中,無論是開始還是至化學平衡狀態,由于反應前后氣體的物質的量不變,氣體的質量不變,所以混合氣體的密度始終不變,D正確。答案選B。
COS(g)+H2O(g),在反應開始中n(CO2)= 0.11mol;n(H2S)=0.41mol; n(H2O)=0;在反應過程中水改變的物質的量是n(H2O)=0.01mol,則根據方程式的系數關系可知,n(CO2)= n(COS)= n(H2S)= n(H2O)=0.01mol。所以平衡時各種物質的物質的量分別是n(CO2)=0.1mol,n(H2S)= 0.4mol;n(COS)= n(H2O)=0.01mol,由于反應前后系數和相等,所以此時K= [c(COS)·c(H2O)] ÷[c(CO2)· c(H2S)] ="(0.01×0.01)÷(0.1×0.4)" =0.0025<6.74×10-3 ,溫度升高,K增大,說明升高溫度,化學平衡向正反應方向移動。根據平衡移動原理,升高溫度,化學平衡向吸熱反應方向移動,所以該反應的正反應是吸熱反應,A正確; B、根據選項A分析可知607K時該反應的平衡常數為K=2.50×10-3 ,若把物質的量均為0.1mol四種反應物加入該反應器中,則Qc=(0.1×0.1)÷(0.1×0.1)=1>0.0025,所以反應逆向進行,V逆>V正,B錯誤;C、該反應是反應前后氣體體積相等的反應,增大壓強,化學平衡不發生移動,所以達到平衡時容器中COS的物質的量為0.02mol,C正確;D、實驗Ⅲ中,無論是開始還是至化學平衡狀態,由于反應前后氣體的物質的量不變,氣體的質量不變,所以混合氣體的密度始終不變,D正確。答案選B。


 新題型全程檢測期末沖刺100分系列答案
新題型全程檢測期末沖刺100分系列答案科目:高中化學 來源: 題型:
【題目】甲醇、氧氣和強堿溶液作電解質的手機電池中的反應為2CH3OH+3O2+40H-![]() 2CO32-+6H2O,有關說法正確的是
2CO32-+6H2O,有關說法正確的是
A. 放電時,CH3OH 參與反應的電極為正極
B. 放電時,負極電極反應:CH3OH+8OH--6e-=CO32-+6H2O
C. 標準狀況下,通入的11.2LO2完全反應有1mol電子轉移
D. 充電時電解質溶液的pH逐漸減小
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以苯酚等有機物為原料制備高分子材料(M)和藥物(N)的一種合成路線如下(部分反應條件略去)
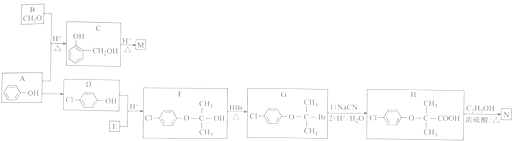
已知: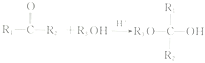 (R1、R2表示氫原子或烴基,R3表示烴基)。
(R1、R2表示氫原子或烴基,R3表示烴基)。
請回答下列問題:
(1)M的結構簡式為_______________。E的化學名稱為_________________。
(2)C中官能團的電子式為__________________。
(3) D的核磁共振氫譜中有_________________組吸收峰。
(4) F→G的反應類型為____________________。
(5)H→N的化學方程式為_____________________________。
(6)同時滿足下列條件的H的同分異構體有_________________種(不考慮立體異構)。
①苯環上連有兩個取代基
②能與FeCl3溶液發生顯色反應
③能與NaHCO3溶液反應生成氣體
(7)已知:一個碳原子上連有兩個羥基的有機物不能穩定存在。參照上述合成路線和信息,以甲醇和乙醇為原料(其他無機試劑任選),設計制備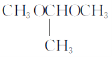 的合成路線:_________________。
的合成路線:_________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某陽離子Mn+的核外共有x個電子,核內有y個中子,則M的質量數為 ( )
A. y-x-n B. y+x+n C. y+x-n D. y-x+n
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法中不正確的有( )個
①反應速率用于衡量化學反應進行的快慢
②可逆反應達到化學平衡狀態時,正、逆反應速率都為0
③決定反應速率的主要因素是反應物的性質
④適當增大反應物濃度,提高反應溫度都能增大反應速率
⑤不管什么反應使用催化劑,都可以加快反應速率 ,并可以使平衡移動。
⑥可逆反應A(g)![]() B(g)+C(g),增大壓強,正反應速率減小,逆反應速率增大
B(g)+C(g),增大壓強,正反應速率減小,逆反應速率增大
⑦對達到平衡的一個放熱的可逆反應,若降溫,則正反應速率減小,逆反應速率增大
A. 2 個 B. 3 個 C. 4 個 D. 5個
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】NA表示阿伏加德羅常數,下列敘述中正確的是( )
A. 常溫常壓下,48g O3所含的原子數為3NA
B. 1mol NH3所含有的原子數為NA
C. 標準狀況下,22.4L水中所含原子數為3 NA
D. 0.1mol/L NaC1溶液中所含Na+數目為0.1 NA
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關說法正確的是( )
A. 2NO(g)+2CO(g)=N2(g)+2CO2(g)在常溫下能自發進行,則該反應的△H>0
B. 對于乙酸與乙醇的酯化反應(△H<0),加入少量濃硫酸并加熱,該反應的反應速率和平衡常數均增大
C. CH3COOH 溶液加水稀釋后,溶液中![]() 的值增大
的值增大
D. Na2CO3溶液中加入少量Ca(OH)2 固體,CO32-水解向左移動,溶液的pH 增大
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化學與生產、生活密切相關。下列敘述中,不正確的是
A.在現實生活中,電化學腐蝕要比化學腐蝕嚴重的多,危害更大
B.用活性炭為糖漿脫色和用臭氧漂白紙漿,原理不同
C.鋼鐵制品和銅制品既能發生吸氧腐蝕又能發生析氫腐蝕
D.在銅的精煉裝置中,通常用粗銅作作陽極,精銅作陰極
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】(NH4)2Fe(SO4)2·6H2O (莫爾鹽,淺綠色)是重要的化工原料和化學試劑。某課題小組為了探究莫爾鹽的分解產物,開展了如下實驗:
(1)甲組同學猜想:莫爾鹽的分解產物可能是N2、Fe2O3、SO3和H2O四種物質。你是否同意甲組同學的猜想,并說明理由:______________________。
(2)乙組同學按照如下圖所示的裝置進行實驗,關閉止水夾,加熱A中的莫爾鹽固體至分解完全,檢驗其分解產物。

①裝置B的儀器名稱是______________,所盛試劑是_________________。
②裝置C中可觀察到的現象是________________, 由此可知硫酸亞鐵銨分解的產物中有___________。
(3)丙組同學選用乙組實驗中的裝置A和下圖所示的裝置,進行實驗驗證莫爾鹽分解的產物中還有SO2和SO3。

①丙組同學的實驗裝置中,依次連接的合理順序為A______________(用裝置字母表示)。取適量固體于A中,通入 N2一段時間后,關閉止水夾,冉點燃酒精燈。通入N2的目的是___________________ 。
②若裝置H中有白色沉淀生成,則證明分解產物中有__________________;能證明分解產物中有SO2的實驗現象是___________________ 。
(4)丁組同學將一定量的莫爾鹽在500℃的隔絕空氣加熱—段時間后,檢驗其固體產物。設計實驗證明,此固體產物不含二價鐵:_______________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com