
| 溫度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| Cu的平均溶解速率 (×10-3mol•min-1) | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
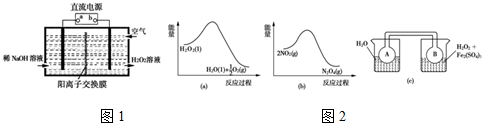
分析 (1)由題給信息氧氣在陰極還原得到H2O2和稀堿的混合物,則b為負極,a為正極;電解法需消耗電能,而催化法常溫下即可進行;
(2)由圖a可知,1mol過氧化氫總能量高于1mol水與0.5mol氧氣總能量,故過氧化氫分解是放熱反應,由圖b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮轉化為四氧化二氮的反應為放熱反應,所以圖c中,右側燒杯的溫度高于左側,升高溫度使2NO2(紅棕色)?N2O4(無色)△H<0,向逆反應方向移動;
(3)溶液變成藍色,銅被氧化成銅離子:Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O;當溫度高于40℃時,銅的平均溶解速率隨著反應溫度的升高而下降,其主要原因是:溫度高于40℃后,隨著溫度的升高,H2O2的分解速率加快,使溶液中H2O2的濃度降低加快,對銅的溶解速率的影響超過了溫度升高對銅溶解速率的影響,所以銅的溶解速率逐漸減小.
解答 解:(1)由題給信息氧氣在陰極還原得到H2O2和稀堿的混合物,則b為負極,a為正極,陰極電極反應式為:O2+2e-+2H2O=H2O2+2OH-,電解需要消耗大量電能,而CO、O2和水在三苯膦鈀的催化下室溫制得了H2O2,不需要額外提供能量,故答案為:正極;O2+2e-+2H2O=H2O2+2OH-;能耗低;
(2)由圖a可知,1mol過氧化氫總能量高于1mol水與0.5mol氧氣總能量,故過氧化氫分解是放熱反應,由圖b可知,2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮轉化為四氧化二氮的反應為放熱反應,所以圖c中,右側燒杯的溫度高于左側,升高溫度使2NO2(紅棕色)?N2O4(無色)△H<0,向逆反應方向移動,即向生成NO2移動,故B瓶顏色更深,
故答案為:深;H2O2分解放熱,使平衡2NO2═N2O4向生成NO2方向移動;
(3)銅與H2O2 和H2SO4 反應生成了硫酸銅,反應方程式是:Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O;由于溫度高于40℃后,隨著溫度的升高,H2O2的分解速率加快,使溶液中H2O2的濃度降低加快,對銅的溶解速率的影響超過了溫度升高對銅溶解速率的影響,所以銅的溶解速率逐漸減小;
故答案為:Cu+H2O2+H2SO4 $\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+2H2O;溫度高于40℃后,隨著溫度的升高,H2O2的分解速率加快,使溶液中H2O2的濃度降低加快,對銅的溶解速率的影響超過了溫度升高對銅溶解速率的影響,所以銅的溶解速率逐漸減小.
點評 本題綜合考查原電池、電解池、化學平衡移動以及化學反應速率的影響等知識,為高考常見題型和高頻考點,側重于學生的分析能力和實驗能力的考查,本題注意把握化學基本理論知識,注意相關知識的積累,難度中等.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應每脫去1mol Cl2會生成1molSO42- | |
| B. | 脫氯反應后的溶液顯酸性 | |
| C. | 根據該反應可判斷還原性:S2O32->Cl- | |
| D. | 反應中硫元素發生了氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| a | b | c | d | |
| I | 干燥的有色布條 | 干燥的有色布條 | 濕潤的有色布條 | 濕潤的有色布條 |
| Ⅱ | 堿石灰 | 硅膠 | 濃硫酸 | 無水氯化鈣 |
| Ⅲ | 濕潤的有色布條 | 濕潤的有色布條 | 干燥的有色布條 | 干燥的有色布條 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 壓強p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 晶體硅與金剛石分子都是正四面體結構 | |
| B. | 硅酸鹽都不溶于水? | |
| C. | 硅與酸、堿都不能發生反應 | |
| D. | 原硅酸和硅酸對應的酸酐都是二氧化硅 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com