
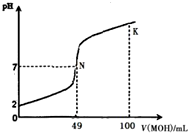
 酸堿中和滴定是最基本的定量分析化學實驗.常溫下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1強堿 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計).下列敘述正確的是( )
酸堿中和滴定是最基本的定量分析化學實驗.常溫下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1強堿 MOH溶液,圖中所示曲線表示混合溶液的pH變化情況(體積變化忽略不計).下列敘述正確的是( )| A. | 由圖中信息可知 HA為強酸,N點為恰好中和 | |
| B. | 常溫下一定濃度的 MA稀溶液的pH<7 | |
| C. | K點所對應的溶液中離子濃度的大小關系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K點對應的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
分析 A.根據圖象可知,0.5mol•L-1HA溶液中pH=2,說明HA為弱酸,N點的pH=7,而兩溶液恰好反應時生成強堿弱酸鹽,溶液顯示堿性;
B.HA為弱酸,則MA為為強堿弱酸鹽,溶液的pH>7;
C.K點時MOH的物質的量是HA的2倍,混合液顯示堿性,則:c(OH-)>c(H+),氫氧根離子來自A-部分水解,則c(OH-)>c(A-);
D.K點時氫氧根離子濃度大于>$\frac{0.5mol/L×(0.1L-0.05L)}{0.15L}$=$\frac{0.5}{3}$mol/L>0.1mol/L,則溶液的pH>13;根據物料守恒可知:c(HA)+c(A-)=$\frac{0.5mol/L×0.05L}{0.15L}$=$\frac{0.5}{3}$mol/L.
解答 解:A.根據圖象可知,0.5mol•L-1HA溶液中pH=2,則HA在溶液中部分電離,故HA為弱酸;當HA與MOH恰好反應時生成強堿弱酸鹽MA,溶液呈堿性,pH>7,而N點的pH=7,說明HA有剩余,故A錯誤;
B.根據A的分析可知,HA為弱酸,MA屬于強堿弱酸鹽,M+部分水解,溶液呈堿性,故B錯誤;
C.在K點時MOH的物質的量是HA的2倍,則混合液顯示堿性:c(OH-)>c(H+),由于氫氧根離子來自A-部分水解,則c(OH-)>c(A-),溶液中各離子濃度大小為:c(M+)>c(OH-)>c(A-)>c(H+),故C正確;
D.K點時氫氧根離子濃度大于>$\frac{0.5mol/L×(0.1L-0.05L)}{0.15L}$=$\frac{0.5}{3}$mol/L>0.1mol/L,則溶液的pH>13;根據物料守恒可得:n(HA)+n(A-)=0.5mol/L×0.05L=0.025mol,則:c(HA)+c(A-)=$\frac{0.025mol}{0.15L}$=$\frac{0.5}{3}$mol/L,故D錯誤;
故選C.
點評 本題考查了酸堿混合的定性判斷及溶液pH的計算、離子濃度定性比較,題目難度中等,根據圖象判斷HA為弱酸為解答關鍵,注意掌握酸堿混合的定性判斷及溶液pH的計算方法,D為易錯點,注意混合液體積為0.15L,不是0.1L.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 將草木灰和硫銨混合使用,相當于施用了氮和鉀的復合肥料,提高了肥料利用率 | |
| B. | 鋁制容器不能長期盛裝酸性或堿性食品,但可用于長期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破壞臭氧層,從而導致了“溫室效應” | |
| D. | 大量使用含磷洗滌劑,可導致水體富營養化 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鍍鋅鐵皮在食鹽水中發生析氫腐蝕 | |
| B. | 電解池的陰極材料一定比陽極材料活潑 | |
| C. | 將鐵器與電源正極相連,可在其表面鍍鋅 | |
| D. | 原電池的負極和電解池的陽極均發生氧化反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1.8g重水(D2O)中含有的質子數和電子數均為NA | |
| B. | 常溫下,16gO2和O3的混合氣體中含有的氧原子數為NA | |
| C. | 標準狀況下,22.4L NO和22.4LO2 混合后所得氣體中分子總數為1.5NA | |
| D. | 將11.2L Cl2通入足量的石灰乳中制備漂白粉,轉移的電子數為0.5NA |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
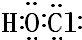 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
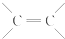 結構的有機物可被高錳酸鉀溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,現以甲基丙烯(
結構的有機物可被高錳酸鉀溶液氧化成二元醇,如:CH2═CH2 $\stackrel{KMnO_{4}溶液}{→}$HOCH2CH2OH,現以甲基丙烯(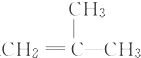 )為原料合成環狀化合物F和高分子化合物E和G.
)為原料合成環狀化合物F和高分子化合物E和G.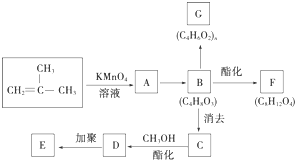
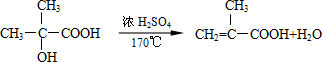 B→G的反應類型:縮聚,G的結構簡式:
B→G的反應類型:縮聚,G的結構簡式: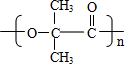 .
.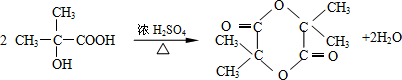 ,兩分子B之間發生酯化反應除生成酯F外,還可能生成另外一種酯,該酯的結構簡式為
,兩分子B之間發生酯化反應除生成酯F外,還可能生成另外一種酯,該酯的結構簡式為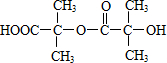 .
.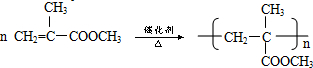 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com