
| A. | 實驗①中產生的氣體為氨氣,并可得原溶液中c(NH4+)=0.1 mol•L-1 | |
| B. | 實驗③中的沉淀中一定有BaSO4,可能有Mg(OH)2 | |
| C. | 若要判斷原溶液中是否有Cl-,無需另外設計實驗驗證 | |
| D. | 原溶液中一定有K+,且c(K+)≥0.4 mol•L-1 |
分析 ①第一份加過量NaOH溶液后加熱,收集到0.02mol氣體,即為氨氣,一定含有NH4+,物質的量為0.02mol,濃度為:$\frac{0.02mol}{0.05L}$=0.4mol/L,無沉淀生成,則一定不含有Fe3+、Mg2+;
②向甲溶液中通入過量CO2,生成白色沉淀,即為氫氧化鋁,則原溶液中一定有Al3+,一定不含有碳酸根離子,鋁離子和過量的氫氧化鈉反應生成偏鋁酸鈉溶液,溶液中通入過量CO2,生成白色沉淀,即為氫氧化鋁,氫氧化鋁沉淀經過濾、洗滌、灼燒后,得到1.02g固體即為氧化鋁,根據鋁元素守恒,得到鋁離子的物質的量是$\frac{1.02g}{102g/mol}$×2=0.02mol,濃度為:$\frac{0.02mol}{0.05L}$=0.4mol/L;
③第二份加足量BaCl2溶液后,生成白色沉淀,則一定含有硫酸根離子,無鋇離子.沉淀經足量鹽酸洗滌、干燥后,得到11.65g固體即硫酸鋇的質量是11.65g,物質的量為:$\frac{11.65g}{233g/mol}$=0.05mol,根據元素守恒,所以硫酸根離子的物質的量是0.05mol,濃度為:$\frac{0.05mol}{0.05L}$=1mol/L,
綜上可知,一定含有的離子是:NH4+、Al3+、SO42-,其濃度分別是:0.4mol/L;0.4mol/L;1mol/L,一定不含Fe3+、Mg2+、Ba2+、SO42,不能確定是否存在氯離子.以此解答該題.
解答 解:①第一份加過量NaOH溶液后加熱,收集到0.02mol氣體,即為氨氣,一定含有NH4+,物質的量為0.02mol,濃度為:$\frac{0.02mol}{0.05L}$=0.4mol/L,無沉淀生成,則一定不含有Fe3+、Mg2+;
②向甲溶液中通入過量CO2,生成白色沉淀,即為氫氧化鋁,則原溶液中一定有Al3+,一定不含有碳酸根離子,鋁離子和過量的氫氧化鈉反應生成偏鋁酸鈉溶液,溶液中通入過量CO2,生成白色沉淀,即為氫氧化鋁,氫氧化鋁沉淀經過濾、洗滌、灼燒后,得到1.02g固體即為氧化鋁,根據鋁元素守恒,得到鋁離子的物質的量是$\frac{1.02g}{102g/mol}$×2=0.02mol,濃度為:$\frac{0.02mol}{0.05L}$=0.4mol/L;
③第二份加足量BaCl2溶液后,生成白色沉淀,則一定含有硫酸根離子,無鋇離子.沉淀經足量鹽酸洗滌、干燥后,得到11.65g固體即硫酸鋇的質量是11.65g,物質的量為:$\frac{11.65g}{233g/mol}$=0.05mol,根據元素守恒,所以硫酸根離子的物質的量是0.05mol,濃度為:$\frac{0.05mol}{0.05L}$=1mol/L,
綜上可知,一定含有的離子是:NH4+、Al3+、SO42-,其濃度分別是:0.4mol/L;0.4mol/L;1mol/L,一定不含Fe3+、Mg2+、Ba2+、SO42,不能確定是否存在氯離子.
A.根據以上分析可知,c (NH4+)=0.4 mol•L-1,故A錯誤;
B.根據以上分析可知,③中的白色沉淀中一定有BaSO4,因溶液不存在鎂離子,則沒有生成氫氧化鎂,故B錯誤;
C.由以上分析可知,不能確定存在氯離子,故C錯誤;
D.任何溶液中都存在電荷守恒,NH4+、Al3+、SO42-,其濃度分別是:0.4mol/L;0.4mol/L;1mol/L,可以知道NH4+、Al3+的正電荷總量小于SO42-負電荷總量,依據電荷守恒,則一定有K+存在,若無氯離子存在,則0.4×1+0.4×3+c(K+)×1=1×2,解得c(K+)=0.4mol/L,故D正確.
故選D.
點評 本題考查離子的檢驗,為高頻考點,側重于學生的分析、計算能力的考查,題目采用定性實驗和定量計算分析相結合的模式,增大了解題難度,同時涉及離子共存、離子反應等都是解題需注意的信息,尤其是K+的確定易出現失誤.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:解答題
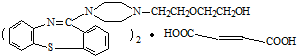 ,它的合成路線如下:
,它的合成路線如下: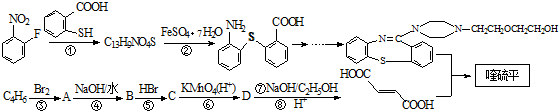
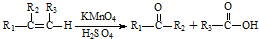
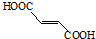 含有的官能團名稱為碳碳雙鍵和羧基.
含有的官能團名稱為碳碳雙鍵和羧基.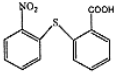 .
.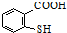 在一定條件下發生縮聚反應的化學方程式為
在一定條件下發生縮聚反應的化學方程式為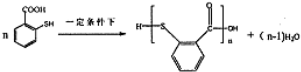 .
.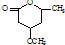 是一種重要的有機化合物.請設計合理方案,完成從
是一種重要的有機化合物.請設計合理方案,完成從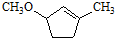 到
到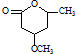 的合成路線流程圖(無機試劑任用).
的合成路線流程圖(無機試劑任用).查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液:Cu2+、H+、Cl-、HSO3- | |
| B. | 能使pH試紙呈紅色的溶液:Na+、Fe2+、Cl-、NO3- | |
| C. | 在水電離出的c(H+)=1×10-12mol/L的溶液中:K+、Fe3+、Cl-、NO3- | |
| D. | $\frac{{K}_{w}}{c({H}^{+})}$=0.1 mol/L的溶液:Na+、K+、SiO32-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.| Ka1 | Ka2 | |
| H2SO3 | 1.3×10-2 | 6.3×10-8 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | NaB溶液的pH=8,c(Na+)-c(B-)=9.9×10-7 mol/L | |
| B. | Na2CO3溶液中,2c(Na+)=c(CO${\;}_{3}^{2-}$)+c(HCO${\;}_{3}^{-}$)+c(H2CO3) | |
| C. | pH相等的①NH4NO3、②(NH4)2SO4、③NH4HSO4三種溶液中,c(NH${\;}_{4}^{+}$)大小順序為:①>②>③ | |
| D. | 10 mL pH=12的氫氧化鈉溶液中加入pH=2的HA溶液至pH剛好等于7,則所得溶液體積V(總)=20 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容.
如圖是某學校實驗室從化學試劑商店買回的硫酸試劑標簽上的部分內容.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 空氣質量日報中有一項重要檢測指標是SO2的含量,結合所學知識回答下列問題.工業制硫酸的過程中,SO2催化氧化的原理為:
空氣質量日報中有一項重要檢測指標是SO2的含量,結合所學知識回答下列問題.工業制硫酸的過程中,SO2催化氧化的原理為:| 實驗編號 | 溫度/℃ | 起始量/mol | 平衡量/mol | ||
| SO2 | O2 | SO2 | O2 | ||
| 1 | T1 | 4 | 2 | x | 0.8 |
| 2 | T2 | 4 | 2 | 0.4 | y |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 5NH4NO3$\frac{\underline{\;\;△\;\;}}{\;}$2HNO3+4N2↑+9H2O的反應中,生成28 g N2,轉移的電子數目為3.75NA | |
| B. | 高溫下,0.2 mol Fe與足量水蒸氣反應,生成的H2分子數目為0.3NA | |
| C. | 氫氧燃料電池正極消耗22.4 L(標準狀況)氣體時,電路中通過的電子數目為4NA | |
| D. | 室溫下,1 L pH=13的NaOH溶液中,由水電離的OH-數目為10-13NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com