
| A. | 標準狀況下,2.24 L水中含有分子數目為0.1NA | |
| B. | 常溫常壓下,6.4 g氧氣和臭氧中含有的原子總數為0.4NA | |
| C. | 5.6 g鐵與一定量硝酸恰好反應,轉移的電子數目一定為0.3NA | |
| D. | 常溫下,2 L 0.1 mol•L-1Na2CO3溶液中,含有的CO32-離子數為0.2NA |
分析 A.標準狀況下,水的狀態不是氣態;
B.氧氣和臭氧都是由O元素組成,根據n=$\frac{m}{M}$計算混合物中含有氧原子的物質的量及數目;
C.5.6g鐵的物質的量為0.1mol,若反應生成硝酸亞鐵,則轉移電子的物質的量為0.2mol;
D.碳酸鈉溶液中,碳酸根離子部分水解,導致碳酸根離子的數目減少.
解答 解:A.標況下水不是氣體,不能使用標況下的氣體摩爾體積計算,故A錯誤;
B.6.4g二者混合物中含有6.4gO原子,含有氧原子的物質的量為:$\frac{6.4g}{16g/mol}$=0.4mol,含有的原子總數為0.4NA,故B正確;
C.5.6g鐵的物質的量為:$\frac{5.6g}{56g/mol}$=0.1mol,若反應生成硝酸亞鐵,則反應失去0.2mol電子,轉移電子的物質的量為0.2mol,轉移的電子數目一定為0.2NA,故C錯誤;
D.2 L 0.1mol•L-1Na2CO3溶液中含有0.2mol碳酸鈉,由于碳酸根離子發生水解,則溶液中含有碳酸根離子的物質的量小于0.2mol,含有的CO32-離子數小于0.2NA,故D錯誤;
故選B.
點評 本題考查了阿伏伽德羅常數的綜合應用,題目難度中等,明確標況下氣體摩爾體積的使用條件為解答結構,注意掌握物質的量與摩爾質量、阿伏伽德羅常數之間的關系,試題有利于提高學生的化學計算能力.


 能力評價系列答案
能力評價系列答案 唐印文化課時測評系列答案
唐印文化課時測評系列答案科目:高中化學 來源: 題型:選擇題
| A. | ②⑤④①③ | B. | ④①②⑤③ | C. | ①④②⑤③ | D. | ⑤②①④③ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 如圖所示的裝置,C、D、E、F、X、Y都惰性電極.將電源接通后,向乙中滴入酚酞試液,在F極附近顯紅色.則以下說不正確的是( )
如圖所示的裝置,C、D、E、F、X、Y都惰性電極.將電源接通后,向乙中滴入酚酞試液,在F極附近顯紅色.則以下說不正確的是( )| A. | 電源B極是負極 | |
| B. | 甲、乙裝置的C、D、E、F電極均有單質生成,其物質的量之比為1~2~2~2√ | |
| C. | 裝置丁中Y極附近紅褐色變深,說明氫氧化鐵膠粒帶正電荷 | |
| D. | 欲用丙裝置給銅鍍銀,H應該是Ag,電鍍液是AgNO3溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | SO2、SiO2、CO、P2O5均為酸性氧化物 | |
| B. | 有色玻璃、稀豆漿、硅酸、氯化鐵溶液均為膠體 | |
| C. | 空氣、福爾馬林、水玻璃、氨水均為混合物 | |
| D. | 燒堿、冰醋酸、四氯化碳、石墨均為電解質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 58.5g NaCl溶于1L水中配得1mol/L NaCl溶液 | |
| B. | 在標準狀況下,44.8LHCl氣體溶于水配成1L溶液,所得溶液中溶質的物質的量濃度為2mol/L | |
| C. | 在標準狀況下,22.4L氨氣溶于水配成1L溶液,從所得溶液中取出10mL,其物質的量濃度為1mol/L | |
| D. | 1mol/L的CaCl2溶液1L,取出100mL,含0.2molCl- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ⑥⑤③②① | B. | ⑦⑤③①② | C. | ④⑤③②①⑨ | D. | ⑥⑤①③② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 金屬鈉與O2反應,條件不同,產物不同 | |
| B. | 少量鈉可保存在煤油中 | |
| C. | 金屬鈉質軟,可以用小刀切割 | |
| D. | 由于鈉很活潑,所以它能從水溶液中置換出金屬活動性順序表中排在鈉后面的金屬 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
實驗I: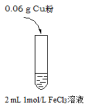 | 實驗現象 |
| i.加入Cu粉后充分振蕩,溶液變成淺藍綠色; ii.取少量i中清液于試管中,滴加2滴1 mol/L KSCN溶液,立即出現白色沉淀,溶液變為紅色,振蕩后紅色迅速褪去;繼續滴加KSCN數滴溶液后,溶液又變為紅色 |
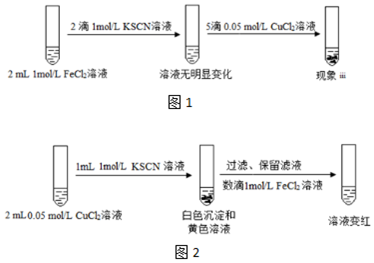
| 實驗IV | 現象 |
| 向2mL 1mol/LFeCl3溶液中加入1滴1mol/L KSCN溶液,再加入足量的Cu粉 | 充分振蕩,溶液紅色褪去,有白色沉淀生成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com