
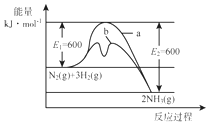
 氨是氮循環(huán)過程中的重要物質(zhì),氨的合成是目前普遍使用的人工固氮方法.
氨是氮循環(huán)過程中的重要物質(zhì),氨的合成是目前普遍使用的人工固氮方法.| 編號 | 溫度/K | 反應時間/h | 反應物質(zhì)的量配比 | 實驗目的 |
| ① | 573 | 4 | 1:3 | 實驗②和④探究溫度對產(chǎn)率的影響 |
| ② | 573 | 4 | 1:4 | |
| ③ | 573 | 3 | 4:1 | 實驗②和③探究反應時間對 產(chǎn)率的影響 |
| ④ | 673 | 4 | 1:4 |
分析 (1)根據(jù)圖1計算出反應熱,寫出熱化學方程式;催化劑能降低反應的活化能;
(2)化學反應達到平衡狀態(tài)時,正逆反應速率相等,各物質(zhì)的濃度不變,由此衍生的一些物理量也不變;
(3)依據(jù)化學平衡三段式列式計算,達到平衡狀態(tài),測得容器中NH3的體積分數(shù)$\frac{1}{9}$,設反應中轉化的xmol氮氣,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
變化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
根據(jù)v(N2)=$\frac{△c({N}_{2})}{t}$計算;根據(jù)k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$計算;
研究該反應在溫度為378~398K時的反應時間、反應物配比等因素對其產(chǎn)率的影響,由控制變量法可知,②和④中只有溫度不同,②和③中只有時間不同;
(4)N2與H2反應時,氮氣得電子,原電池正極發(fā)生得電子的還原反應.
解答 解:(1)由圖1可知,1molN2(g)與3molH2(g)完全反應生成2molNH3(g)的反應熱為508kJ/mol-600kJ/mol=-92kJ/mol,
所以合成氨的熱化學反應方程式為N2(g)+3H2(g)?2NH3(g)△H═-92kJ/mol,催化劑能降低反應的活化能,b活化能較低,所以b表示加入鐵觸媒的能量變化曲線;
故答案為:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1;b;
(2)A.該反應達到平衡狀態(tài)時,2v(H2)正=3v(NH3)逆,故A錯誤;
B.單位時間內(nèi)生成n mol N2的同時生成2n molNH3,分別表示正逆反應速率,而且正逆速率之比等于化學計量數(shù)之比,所以該反應達到平衡狀態(tài),故B正確;
C.無論該反應是否達到平衡狀態(tài),混合氣體的密度始終不變,所以不能判斷該反應是否達到平衡狀態(tài),故C錯誤;
D.該反應是一個反應前后氣體體積減小的可逆反應,當反應達到平衡狀態(tài)時,容器內(nèi)壓強不隨時間的變化而變化,所以能判斷反應是否達到平衡狀態(tài),故D正確;
E.斷開一個氮氮鍵,表示正反應速率,形成3個氫氫鍵表示逆反應速率,而且正逆反應速率之比等于計量數(shù)比,所以反應達到平衡狀態(tài),故E正確;
F.參加反應的物質(zhì)的濃度之比與反應物的初始濃度和轉化率有關,所以C(N2):C(H2):C(NH3)=1:3:2,不一定達到平衡狀態(tài),故F錯誤;
故答案為:BDE;
(3)達到平衡狀態(tài),測得容器中NH3的體積分數(shù)$\frac{1}{9}$,設反應中轉化的xmol氮氣,
N2(g)+3H2(g)?2NH3(g)
起始量(mol) 1 3 0
變化量(mol) x 3x 2x
平衡量(mol) 1-x 3-3x 2x
則$\frac{2x}{1-x+3-3x+2x}$=$\frac{1}{9}$,解得x=0.2,
v(N2)=$\frac{△c({N}_{2})}{t}$=$\frac{\frac{0.2mol}{2L}}{0.5min}$=0.2mol/(L•min);
k=$\frac{{c}^{2}(N{H}_{3})}{c({N}_{2})•{c}^{3}({H}_{2})}$=$\frac{(\frac{0.4mol}{2L})^{2}}{\frac{0.8mol}{2L}×(\frac{2.4mol}{2L})^{3}}$=$\frac{25}{432}$;
研究該反應在溫度為378~398K時的反應時間、反應物配比等因素對其產(chǎn)率的影響,由控制變量法可知,
實驗①和③,溫度相同,反應時間相同,應研究反應物配比對氧化鎂產(chǎn)率的影響,③中反應物配比應為4:1;
實驗②和④,反應時間相同,反應物配比相同,溫度不同,應是探究溫度對產(chǎn)率的影響;
實驗②和③,溫度相同、反應物配比相同,反應時間不同,探究反應時間對產(chǎn)率的影響.
故答案為:0.2mol/(L•min);$\frac{25}{432}$;4:1;溫度對產(chǎn)率的影響;③;
(4)以N2、H2為原料,以HCl-NH4Cl為電解質(zhì)溶液構成新型燃料電池,正極發(fā)生還原反應,即氮氣被還原生成NH4+,電極反應式為N2+6e-+8H+=2NH4+,
故答案為:N2+6e-+8H+=2NH4+.
點評 本題考查較為綜合,涉及化學平衡的計算、化學平衡狀態(tài)的判斷、探究反應速率的影響因素、原電池等知識,題目難度中等,注意把握三段式在化學平衡計算中的應用方法,側重于考查學生的分析能力和計算能力.


科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 電解飽和食鹽水時陽極的電極反應式為:2Cl--2e-═Cl2↑ | |
| B. | 氫氧燃料電池的負極反應式:O2+2H2O+4e-═4OH- | |
| C. | 粗銅精煉時,與電源正極相連的是銅 | |
| D. | 鋼鐵發(fā)生電化學腐蝕的正極反應式:Fe-2e-═Fe2+ |
查看答案和解析>>
科目:高中化學 來源: 題型:實驗題
 某化學興趣小組為探究銅與濃硫酸的反應以及SO2的性質(zhì),用右圖所示裝置進行有關實驗.請回答下列問題:
某化學興趣小組為探究銅與濃硫酸的反應以及SO2的性質(zhì),用右圖所示裝置進行有關實驗.請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
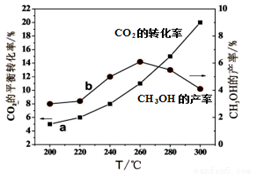 甲醇是一種可再生能源,由CO2制備甲醇的過程可能涉及的反應如下:
甲醇是一種可再生能源,由CO2制備甲醇的過程可能涉及的反應如下:| 溫度(℃) | 500 | T |
| CO2的平衡轉化率 | 60% | 40% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
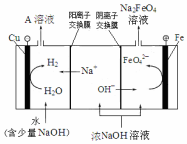 高鐵酸鉀(K2FeO4)是一種新型、高效、多功能水處理劑.
高鐵酸鉀(K2FeO4)是一種新型、高效、多功能水處理劑.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com