
分析 在一定條件下,2.30g固體B與5.35gNH4Cl固體恰好完全反應,生成固體C和4.48L氣體D(標準狀況),氣體D能使濕潤的紅色石蕊試紙變藍色,可推知D為NH3,4.48L氨氣的物質的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其質量=0.2mol×17g/mol=3.4g,根據質量守恒可知B的質量為2.3g+5.35g-3.4g=4.25g,NH4Cl的摩爾質量為53.5g/mol,5.35gNH4Cl為0.1mol,B中含Li,則固體B與NH4Cl固體反應可表為:B+NH4Cl→LiCl+NH3,根據Cl原子守恒,LiCl的物質的量=0.1mol,那么2.3g化合物B中含Li元素也為 0.1mol,再根據質量守恒和原子守恒(原子的種類和數目反應前后相同),則2.3gB中含有N原子為0.2mol-0.1mol=0.1mol,含有H原子為0.2mol×4-0.4mol=0.2mol,可推知B是LiNH2,液氨與金屬鋰反應生成氫氣和LiNH2,
(1)B是LiNH2,根據A(s)+H2(g)$?_{釋氫}^{貯氫}$B(s)+LiH(s),利用元素守恒可知A的化學式,離子半徑大小,Li+,H-,電子層數相同,核電荷數越大半徑越小;
(2)B是LiNH2,液氨與金屬鋰反應生成氫氣和LiNH2;
(3)推知B是LiNH2,根據元素守恒可知,B在加強熱時發生分解反應,生成NH3和另一種化合物E為Li3N,據此書寫化學方程式;
(4)根據A和E儲氫量的多少選擇儲氫材料.
解答 解:在一定條件下,2.30g固體B與5.35gNH4Cl固體恰好完全反應,生成固體C和4.48L氣體D(標準狀況),氣體D能使濕潤的紅色石蕊試紙變藍色,可推知D為NH3,4.48L氨氣的物質的量=$\frac{4.48L}{22.4L/mol}$=0.2mol,其質量=0.2mol×17g/mol=3.4g,根據質量守恒可知B的質量為2.3g+5.35g-3.4g=4.25g,NH4Cl的摩爾質量為53.5g/mol,5.35gNH4Cl為0.1mol,B中含Li,則固體B與NH4Cl固體反應可表為:B+NH4Cl→LiCl+NH3,根據Cl原子守恒,LiCl的物質的量=0.1mol,那么2.3g化合物B中含Li元素也為 0.1mol,再根據質量守恒和原子守恒(原子的種類和數目反應前后相同),則2.3gB中含有N原子為0.2mol-0.1mol=0.1mol,含有H原子為0.2mol×4-0.4mol=0.2mol,可推知B是LiNH2,液氨與金屬鋰反應生成氫氣和LiNH2,
(1)B是LiNH2,根據A(s)+H2(g)$?_{釋氫}^{貯氫}$B(s)+LiH(s),利用元素守恒可知A的化學式為Li2NH,離子半徑大小,Li+,H-,電子層數相同,核電荷數越大半徑越小,LiH中r(Li+)小于r(H-),
故答案為:Li2NH;小于;
(2)B是LiNH2,液氨與金屬鋰反應生成氫氣和LiNH2,反應的方程式為2Li+2NH3=2LiNH2+H2,
故答案為:2Li+2NH3=2LiNH2+H2;
(3)推知B是LiNH2,根據元素守恒可知,B在加強熱時發生分解反應,生成NH3和另一種化合物E為Li3N,反應的化學方程式為3LiNH2$\frac{\underline{\;高溫\;}}{\;}$Li3N+2NH3,
故答案為:3LiNH2$\frac{\underline{\;高溫\;}}{\;}$Li3N+2NH3;
(4)根據A的化學式為Li2NH,E為Li3N可知,E的儲氫量要比A多,所以選擇選擇儲氫材料E比較合理,
故答案為:E,E的儲氫量要比A多.
點評 本題考查無機物推斷,側重考查學生對知識的遷移應用與綜合分析解決問題能力,對學生的邏輯推理有較高的要求,把握A中含Li元素,B物質化學式的推斷是解題關鍵,難度較大.


科目:高中化學 來源: 題型:選擇題
| A. | x=4 | B. | 平衡向正反應方向移動 | ||
| C. | B的轉化率降低 | D. | C的體積分數增大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 除去粗鹽中不溶性雜質的操作有溶解、過濾、蒸發 | |
| B. | 教材上鋁熱反應實驗中KClO3的作用是使鎂帶劇烈燃燒 | |
| C. | 石蠟油蒸氣在熾熱碎瓷片的作用下分解產生的氣體可使酸性高錳酸鉀溶液褪色 | |
| D. | 除去乙醇中少量的水采用加入新制的Ca(OH)2再蒸餾的方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 電解質溶液 | H2SO4溶液 | KOH溶液 |
| 負極反應式 | ||
| 正極反應式 | ||
| 溶液的pH變化 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
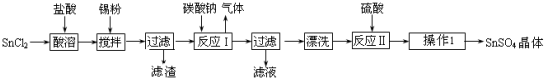
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
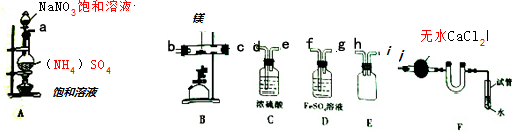
| 空硬質玻璃管質量 | 硬質玻璃管與鎂的質量 | 硬質玻璃管與產物的質量 |
| 142.312g | 142.480g | 142.550g |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | NH4+可能存在 | |
| B. | 若焰色反應測得K+存在,則NH4+不一定存在 | |
| C. | Cl-不可能存在 | |
| D. | Ba2+一定不存在,Mg2+可能存在 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com