
| 電解質溶液 | H2SO4溶液 | KOH溶液 |
| 負極反應式 | ||
| 正極反應式 | ||
| 溶液的pH變化 |
分析 (1)根據電池反應式可知在反應中H2被氧化,O2被還原.H2應該在負極上反應,O2應該在正極上反應;
(2)酸性溶液,此時應考慮不可能有OH-生成,所以負極發生氧化反應,電極反應為H2-2e-=2H+,正極發生還原反應,電極反應為O2+4H++4e-=2H2O,生成水導致氫離子濃度減少,pH增大;H2應該在負極上反應,O2應該在正極上反應,又因為是堿性溶液,不可能有H+參加或生成,生成水導致氫氧根離子的濃度減小;
(3)如把H2改為甲烷,KOH溶液做電解質,甲烷在負極失電子發生氧化反應在堿溶液中生成碳酸鹽.
解答 解:(1)根據電池反應式可知在反應中H2被氧化,O2被還原.H2應該在負極上反應,O2應該在正極上反應,故答案為:H2;O2;
(2)酸性溶液,此時應考慮不可能有OH-生成,所以負極發生氧化反應,電極反應為H2-2e-=2H+,正極發生還原反應,電極反應為O2+4H++4e-=2H2O,生成水導致氫離子濃度減少,pH增大,所以H2SO4溶液:負極:H2-2e-=2H+;正極:O2+4H++4e-=2H2O;溶液的pH變化:增大;
H2應該在負極上反應,O2應該在正極上反應,正極的電極反應為O2+2H2O+4e-=4OH-;又因為是堿性溶液,不可能有H+參加或生成,故負極的電極反應為H2-2e-+2OH-=2H2O,生成水導致氫氧根離子的濃度減小,所以溶液的pH減小,所以KOH溶液:負極:H2-2e-+2OH-=2H2O;正極:O2+2H2O+4e-=4OH-;溶液的pH變化:減小,
故答案為:
| 電解質溶液 | H2SO4溶液 | KOH溶液 |
| 負極反應式 | H2-2e-=2H+ | H2-2e-+2OH-=2H2O |
| 正極反應式 | O2+4H++4e-=2H2O | O2+2H2O+4e-=4OH- |
| 溶液的pH變化 | 增大 | 減小 |
點評 本題考查了原電池原理、組成、電極名稱和電極反應的分析判斷,注意不同電解質溶液中電極反應產物的書寫,掌握基礎是關鍵,題目難度中等.


 學練快車道快樂假期暑假作業新疆人民出版社系列答案
學練快車道快樂假期暑假作業新疆人民出版社系列答案 浙大優學小學年級銜接導與練浙江大學出版社系列答案
浙大優學小學年級銜接導與練浙江大學出版社系列答案 小學暑假作業東南大學出版社系列答案
小學暑假作業東南大學出版社系列答案 津橋教育暑假拔高銜接廣東人民出版社系列答案
津橋教育暑假拔高銜接廣東人民出版社系列答案 波波熊暑假作業江西人民出版社系列答案
波波熊暑假作業江西人民出版社系列答案科目:高中化學 來源: 題型:解答題
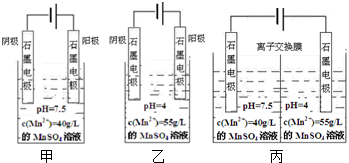
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
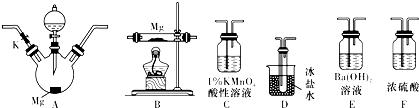
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
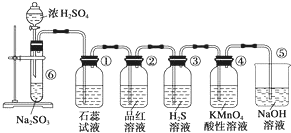 圖是實驗室制取SO2并驗證SO2的某些性質的裝置,試回答:
圖是實驗室制取SO2并驗證SO2的某些性質的裝置,試回答:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2CO3、H2SiO3、HClO都屬于弱酸 | B. | Na2O、MgO、Al2O3都屬于堿性氧化物 | ||
| C. | 石英、純堿、明礬都屬于鹽 | D. | 堿石灰、鐵紅、水泥都屬于混合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 向某溶液中滴入足量鹽酸,如觀察到無色無味的氣體產生,且能使澄清石灰水變渾濁,即證明溶液中必定有CO32- | |
| B. | 向某無色溶液中加入BaCl2溶液,有白色沉淀出現,再加入稀鹽酸,沉淀不消失,無法證明溶液一定含有SO42- | |
| C. | 向某無色溶液中加入少量稀氫氧化鈉溶液后,用濕潤的藍色石蕊試紙靠近試管口,若試紙變紅,則說明該溶液中有NH4+ | |
| D. | 如透過藍色的鈷玻璃能夠觀察到紫色火焰,則一定有鉀元素,一定不含有鈉元素 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
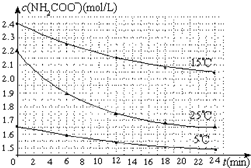 某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定.
某研究小組在實驗室探究氨基甲酸銨(NH2COONH4)分解反應平衡常數和水解反應速率的測定.| 溫度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡總壓強(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡氣體總濃度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com