
| 物質 | X | Y | Z |
| 初始濃度/mol•L-1 | 0.1 | 0.2 | 0 |
| 平衡濃度/mol•L-1 | 0.05 | 0.05 | 0.1 |
| A. | 反應達到平衡時,X的轉化率為50% | |
| B. | 改變溫度可以改變此反應的平衡常數 | |
| C. | 增大壓強使平衡向生成Z的方向移動,平衡常數增大 | |
| D. | 反應可表示為X+3Y?2Z,其平衡常數為1600 |
分析 A.X的轉化率=$\frac{X濃度變化量}{X起始濃度}$×100%;
B.平衡常數只受溫度影響,溫度變化,平衡常數也發生變化;
C.平衡常數只受溫度影響;
D.X、Y濃度減小,為反應物,Z的濃度增大,為生成物,且最終X、Y濃度不為0,說明為可逆反應,X、Y、Z化學計量數之比為(0.1-0.05)mol/L:(0.2-0.05)mol/L:0.1mol/L=1:3:2,反應可表示為X+3Y?2Z,平衡常數K=$\frac{{c}^{2}(Z)}{c(X)×{c}^{3}(Y)}$.
解答 解:A.反應達到平衡時,X的轉化率為$\frac{(0.1-0.05)mol/L}{0.1mol/L}$=50%,故A正確;
B.平衡常數只受溫度的影響,溫度改變時,化學平衡常數一定變化,故B正確;
C.平衡常數只受溫度的影響,壓強改變平衡常數不變,故C錯誤;
D.X、Y濃度減小,為反應物,Z的濃度增大,為生成物,且最終X、Y濃度不為0,說明為可逆反應,X、Y、Z化學計量數之比為(0.1-0.05)mol/L:(0.2-0.05)mol/L:0.1mol/L=1:3:2,則反應的方程式為X+3Y?2Z,平衡常數K=$\frac{{c}^{2}(Z)}{c(X)×{c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.05×0.0{5}^{3}}$=1600,故D正確;
故選C.
點評 本題考查化學平衡計算、平衡常數計算及影響因素,難度不大,注意平衡常數只受溫度影響.


 科學實驗活動冊系列答案
科學實驗活動冊系列答案科目:高中化學 來源:2017屆廣西桂林十八中高三上10月月考化學試卷(解析版) 題型:選擇題
金屬(M)–空氣電池(如圖)具有原料易得、能量密度高等優點,有望成為新能源汽車和移動設備的電源。該類電池放電的總反應方程式為:4M+nO2+2nH2O=4M(OH) n。已知:電池的“理論比能量”指單位質量的電極材料理論上能釋放出的最大電能。下列說法不正確的是( )
A.采用多孔電極的目的是提高電極與電解質溶液的接觸面積,并有利于 氧氣擴散至電極表面
氧氣擴散至電極表面
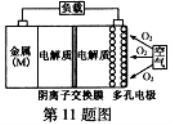 B.比較Mg、Al、Zn三種金屬–空氣電池,Al–空氣電池的理論比能量最高
B.比較Mg、Al、Zn三種金屬–空氣電池,Al–空氣電池的理論比能量最高
C.M–空氣電池放電過程的正極反應式:4Mn++nO2+2nH2O+4ne–=4M(OH)n
D.在M–空氣電池中,為防止負極區沉積Mg(OH)2,宜采用中性電解質及陽離子交換膜
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 50% | B. | 60% | C. | 80% | D. | 90% |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 硫代硫酸鈉(Na2S2O3)可用做分析試劑及鞣革還原劑.它受熱、遇酸易分解.工業上可用反應:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,實驗室模擬該工業過程的裝置如圖所示.(說明:a中盛放稀硫酸;b中盛放Na2SO3固體)回答下列問題:
硫代硫酸鈉(Na2S2O3)可用做分析試劑及鞣革還原劑.它受熱、遇酸易分解.工業上可用反應:2Na2S+Na2CO3+4SO2═3Na2S2O3+CO2制得,實驗室模擬該工業過程的裝置如圖所示.(說明:a中盛放稀硫酸;b中盛放Na2SO3固體)回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度 CO2轉化率 $\frac{n({H}_{2})}{n(C{O}_{2})}$ | 500K | 600K | 700K | 800K |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 過量二氧化錳與濃鹽酸共熱反應 | |
| B. | 過量的氫氣與少量氮氣在一定條件下充分反應 | |
| C. | 過量銅與濃硫酸共熱反應 | |
| D. | 過量氨水與硝酸銀溶液反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | C(CH3COOH) | B. | C(H+) | C. | C(H+)/C(CH3COOH) | D. | C(CH3COOH)/C(H+) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com