
(1)配平可逆反應:![]()
已知400℃時,1.6 mol NO和NH3混合氣體發生以上反應達到平衡后,混合氣體的物質的量變為1.7 mol,則被氧化的N的物質的量為 。
(2)已知某溫度下0.01 mol/L鹽酸溶液中水電離的c(H+)=l x 10-11mol/L,則Kw= ;若在此溫度下將pH==a的NaOH溶液與pH=b的鹽酸按1:100體積剛好完全反應,a、b應滿足關系為 。
(3)有一種白色固體,可能含有CaCO3、Ba(N O3)2、NH4 C1、KCl、A gN O3、Al2(SO4)3
和KMnO4中的一種或幾種。①將白色固體用水溶解并過濾,②將濾渣加入足量鹽酸中,濾渣全部溶解并放出氣體;③向濾液中加入足量濃NaOH溶液,加熱,放出能使濕潤紅色石蕊試紙變藍的氣體,待溶液冷卻后,繼續滴入適量的稀鹽酸,有白色沉淀產生。則該白色固體中一定有 ,可能有 。
本題考查氧化還原反應的配平及計算、有關溶液pH計算和物質的檢驗。
(1)該反應是氧化還原反應,可用得失電子法配平,6NO+4NH3![]() 5N2+6H2O,按化學平衡方程式計算:6NO+4NH3
5N2+6H2O,按化學平衡方程式計算:6NO+4NH3![]() 5N2+6H2O △n
5N2+6H2O △n
6 4 1
x y 1.7 mol-1.6 mol= 0.1mol
解得:x=0.6 mol y=0.4 mol,NH3被氧化,則被氧化的N的物質的量為0.4 mol。
(2)在水溶液中,水電離H2O![]() H++OH-,故c(H+)水=c(OH-)水=lx10-11mol/L,c(OH-)aq=c(OH-)水=lx10-11mol/L,c(H+)aq= c(HCl)= 0.01 mol/L,Kw= c(H+)aq ×c(OH-)aq= 0.01×lx10-11= l x10-13;pH=a的NaOH溶液中c(OH-)=lx10-13/10-a=10 a -13mol/L,pH=b的鹽酸中c(H+)=10 -bmol/L,據H++OH-=H2O,則10 -bmol/L×100=10 a -13mol/L×1,得a+b=11。
H++OH-,故c(H+)水=c(OH-)水=lx10-11mol/L,c(OH-)aq=c(OH-)水=lx10-11mol/L,c(H+)aq= c(HCl)= 0.01 mol/L,Kw= c(H+)aq ×c(OH-)aq= 0.01×lx10-11= l x10-13;pH=a的NaOH溶液中c(OH-)=lx10-13/10-a=10 a -13mol/L,pH=b的鹽酸中c(H+)=10 -bmol/L,據H++OH-=H2O,則10 -bmol/L×100=10 a -13mol/L×1,得a+b=11。
(3) 由①可知沒有KMnO4(紫色)存在,由②可知有CaCO3存在,由③可知有NH4 C1、Al2(SO4)3存在,由于NH4 C1、Al2(SO4)3存在,則Ba(N O3)2 、A gN O3不能存在(會與前者產生沉淀,不溶解于足量鹽酸)。故一定有CaCO3、NH4 C1、Al2(SO4)3存在,可能有KCl。


 名校聯盟沖刺卷系列答案
名校聯盟沖刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 課程達標測試卷闖關100分系列答案
課程達標測試卷闖關100分系列答案科目:高中化學 來源: 題型:
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源: 題型:
I.科學家一直致力于“人工固氮”的新方法研究。
(l)目前合成氨技術原理為:![]() △
△![]()
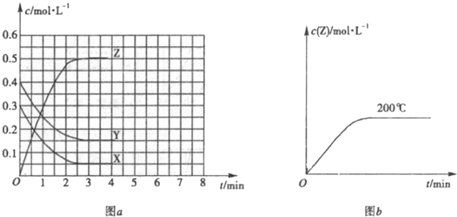
 下圖表示工業合成氨反應在某一段時間中反應速率與反應過程的關系曲線圖:
下圖表示工業合成氨反應在某一段時間中反應速率與反應過程的關系曲線圖:
①氫化物的體積分數最高的一段時間為 ;![]() 時刻改變的反應條件是 。
時刻改變的反應條件是 。
②![]() 極易溶于水,其水溶液俗稱氨水。用水稀釋
極易溶于水,其水溶液俗稱氨水。用水稀釋![]() 的氨水,溶液中隨著水量的增加而減小的是 (填序號)。
的氨水,溶液中隨著水量的增加而減小的是 (填序號)。
![]()
![]()
![]()
![]()
(2)1998年希臘亞里士多德大學的兩位科學家采用高質子導電性的SCY冉瓷(能傳遞![]() ),實現了高溫常壓下利用
),實現了高溫常壓下利用![]() 和
和![]() 電解合成氨。其陰極的電極反應式 。
電解合成氨。其陰極的電極反應式 。
(3)根據最新“人工固氮”的研究報道,在常溫、常壓、光照條件下,![]() 在催化劑(摻有少量
在催化劑(摻有少量![]() 的
的![]() )表面與水發生下列反應:
)表面與水發生下列反應:
![]() △
△![]() 進一步研究
進一步研究![]() 生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如下表
生成量與溫度的關系,常壓下達到平衡時測得部分實驗數據如下表
| 303 | 313 | 323 |
| 4.8 | 5.9 | 6.0 |
①此合成反應的![]() 0,△
0,△![]() 0,(填“>”“<”或“=”)。
0,(填“>”“<”或“=”)。
②已知:![]() △
△![]() ;
;
![]() △
△![]()
則![]() △
△![]() = 。
= 。
II.已知可逆反應![]() (未配平)△
(未配平)△![]() 。溫度為
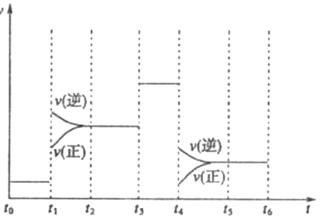
。溫度為![]() 時,在容積固定的容器中發生反應,各物質的濃度隨時間變化的關系如圖
時,在容積固定的容器中發生反應,各物質的濃度隨時間變化的關系如圖![]() 所示。
所示。
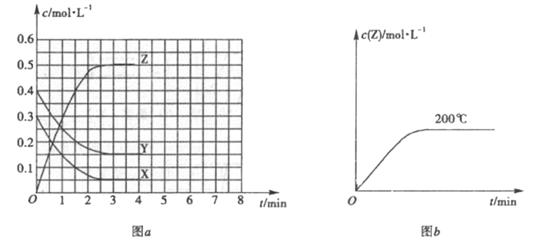
(1)![]() ℃時,該反應的平衡常數為
℃時,該反應的平衡常數為
(2)圖![]() 為200℃時容器內
為200℃時容器內![]() 的變化曲線,請在圖中補畫該反應在100℃時的
的變化曲線,請在圖中補畫該反應在100℃時的![]() 的
的
變化曲線。
查看答案和解析>>
科目:高中化學 來源:2010年山東省聊城市高考化學二模試卷(解析版) 題型:解答題

查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com