

| 滴定次數 | 1 | 2 | 3 | 4 |
| KMnO4溶液體積/mL | 20.90 | 20.02 | 19.98 | 20.00 |
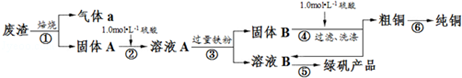
分析 廢棄固體主要成分Cu2S和Fe2O3,灼燒廢氣固體發生反應Cu2S+2O2$\frac{\underline{\;高溫\;}}{\;}$SO2+2CuO,所以氣體a是SO2,固體A是CuO和Fe2O3,固體A和稀硫酸混合,發生的反應為CuO+H2SO4=CuSO4+H2O、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,所以溶液A中成分為CuSO4、Fe2(SO4)3,向溶液A中加入過量Fe屑,發生反應CuSO4+Fe=FeSO4+Cu、2Fe2(SO4)3+Fe=3FeSO4,所以固體B成分是Fe、Cu,濾液B成分為FeSO4,固體B和稀硫酸混合,Fe和稀硫酸反應生成FeSO4,Cu和稀硫酸不反應,過濾得到固體粗銅,據此分析解答.
解答 解:(1)欲用98%的濃硫酸(密度為1.84g•mL-1)配制500mL1.0mol•L-1的硫酸,需要的儀器除量筒、燒杯、玻璃棒、滴定達到刻度線時用膠頭滴管,配制在500mL容量瓶中進行,
故答案為:膠頭滴管、500mL容量瓶;
(2)①裝置A中反應的化學方程式為:2Na2O2+2H2O=4NaOH+O2↑,通過控制水的流速來控制反應的速率,所以可以打開分液漏斗上口活塞,控制分液漏斗旋塞,使水勻速逐滴滴下,B裝置應是干燥裝置,所以用堿石灰的干燥管(或U形管)或濃硫酸的洗氣瓶,
故答案為:2Na2O2+2H2O=4NaOH+O2↑;打開分液漏斗上口活塞,控制分液漏斗旋塞,使水勻速逐滴滴下;堿石灰的干燥管(或U形管)或濃硫酸的洗氣瓶;
②E裝置中加入品紅溶液的目的是檢驗氣體a中的SO2;是未反應的氧氣與二氧化硫在水溶液中發生氧化還原反應,生成硫酸根離子,與鋇離子結合生成硫酸鋇白色沉淀,所以反應方程式為:2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+,
故答案為:檢驗氣體a中的SO2;2SO2+O2+2H2O+2Ba2+=2BaSO4↓+4H+;
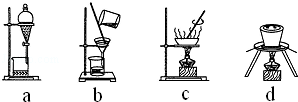
(3)步驟⑤是在還原性體系中蒸發濃縮結晶過濾,所以涉及的裝置為:bc,不屬于的是ad,
故答案為:ad;
(4)①第1組實驗數據出現異常,消耗高錳酸鉀溶液體積變大,
a.酸式滴定管用蒸餾水洗凈后未用標準液潤洗,標準液的濃度變小,消耗高錳酸鉀溶液體積變大,故正確;
b.錐形瓶洗凈后未干燥,無影響,故錯誤;
c.滴定終點時俯視讀數,高錳酸鉀溶液體積變小,故錯誤;
d.滴定終點時仰視讀數,高錳酸鉀溶液體積變大,故正確;
故選:ad;
②第2、3、4組求平均值,消耗KMnO4溶液體積為:$\frac{20.02+19.98+20.00}{3}$=20ml,由10FeSO4+8H2SO4+2KMnO4=2MnSO4+5Fe2(SO4)3+K2SO4+8H2O得:
10FeSO4~~2KMnO4,
10×152 2
m 20ml×0.1000mol•L-1×10-3
m=$\frac{10×152×20ml×0.1000mol•L{\;}^{-1}×10{\;}^{-3}}{2}$=1.52g,所以綠礬的物質的為量為:$\frac{1.52g}{152g/mol}$=0.1mol;所以綠礬的質量分數為:$\frac{0.1×(152+126)}{30}$×100%=92.7%,故答案為:92.7%.
點評 本題考查混合物的分離和提純,側重考查學生分析問題、實驗操作、思維縝密性等能力,明確物質的性質是解本題關鍵,能從整體上分析各個步驟發生的反應,能正確書寫相應的化學方程式和離子方程式,題目難度中等.


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:選擇題
 實驗室采購了部分化學藥品.如圖是從化學試劑商店買回的硫酸試劑標簽上的部分內容.下列說法正確的是( )
實驗室采購了部分化學藥品.如圖是從化學試劑商店買回的硫酸試劑標簽上的部分內容.下列說法正確的是( )| A. | 該硫酸的物質的量濃度為9.2mol•L-1 | |
| B. | 1molAl與足量的該硫酸反應產生3g氫氣 | |
| C. | 這種硫酸在常溫下不能使鐵鈍化 | |
| D. | 配制80mL2.3mol•L-1的稀硫酸需量取該硫酸12.5 mL |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 原電池是把電能轉變為化學能的裝置 | |
| B. | 原電池中電子流出的一極是負極,發生氧化反應 | |
| C. | 原電池的兩極發生的反應均為氧化還原反應 | |
| D. | 形成原電池后,原電池中的陽離子向負極方向移動 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | CrO42-和S2-在酸性溶液中可大量共存 | |
| B. | 實驗②說明氧化性:Cr2O72->SO42- | |
| C. | 稀釋K2Cr2O7溶液時,溶液中各離子濃度均減小 | |
| D. | 實驗①和②均能證明K2Cr2O7溶液中存在上述平衡 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
. +CH3CH2OH$→_{△}^{濃H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{濃H_{2}SO_{4}}$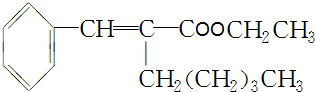 +H2O.
+H2O.查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
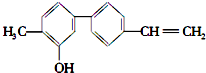
| A. | 由于含有氧元素不是有機物 | B. | 該物質的分子式是 C15H14O | ||
| C. | 分子中含有羥基屬于醇 | D. | 分子中有三種官能團 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 元素Q是短周期非金屬性最強的元素 | |
| B. | Y、Z形成的化合物中只有一種屬于酸性氧化物 | |
| C. | Y、Z、Q分別與W形成的化合物中,Z形成的化合物的沸點最高 | |
| D. | X分別與Y、Z、W形成的化合物中可能既含離子鍵又含共價鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com