
 (1)已知H-H 鍵能為436kJ•mol-1,H-N鍵鍵能為391kJ•mol-1,根據化學方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.則N≡N鍵的鍵能是945.6 kJ/mol
(1)已知H-H 鍵能為436kJ•mol-1,H-N鍵鍵能為391kJ•mol-1,根據化學方程式:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ•mol-1.則N≡N鍵的鍵能是945.6 kJ/mol分析 (1)反應熱=反應物的總鍵能-生成物的總鍵能,以此解答;
(2)能設計成原電池的反應通常是放熱反應,且必須是能自發進行的氧化還原反應;
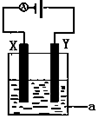
(3)原電池中,正極上氧化劑得電子發生還原反應;
(4)①若電解硫酸銅溶液時,陽極上氫氧根離子放電,陰極上銅離子放電,據此寫出電池反應式,根據銅和轉移電子正極的關系式計算;
②根據轉移電子守恒計算陰極上析出的物質,再根據氧氣計算生成的C(H+),從而得出其pH;
③工業精煉銅時,陽極是粗銅,電解液為含銅離子的溶液.
解答 解:(1)已知:H-H鍵能為436kJ/mol,H-N鍵能為391kJ/mol,令N≡N的鍵能為x,
對于反應N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ/mol,
反應熱=反應物的總鍵能-生成物的總鍵能,故x+3×436kJ/mol-2×3×391kJ/mol=-92.4kJ/mol,
解得:x=945.6 kJ/mol,故答案為:945.6 kJ/mol;
(2)能設計成原電池的反應通常是放熱反應,且必須是能自發進行的氧化還原反應,
A.該反應是吸熱反應,所以不能設計成原電池,故不選;
B.該反應是放熱反應且能自發的進行氧化還原反應,所以能設計成原電池,故選;
C.該反應不是氧化還原反應,所以不能設計成原電池,故不選;
故選:B;
(3)以KOH溶液為電解質溶液的氫氧燃料電池中,正極上氧氣得電子和水反應生成氫氧根離子,電極反應式為:O2+2H2O+4e-=4OH-,故答案為:O2+2H2O+4e-=4OH-;
(4)①電解硫酸銅溶液時,陽極上生成氧氣,陰極上生成銅,同時溶液中生成硫酸,所以電池反應式為:2CuSO4+2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+2H2SO4,故答案為:2CuSO4+2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+2H2SO4;
②電解含有0.04molCuSO4和0.04molNaCl的混合溶液400ml,陽極上先生成氯氣后生成氧氣,陰極上先生成銅,后生成氫氣,陽極上氯氣完全析出時,氯氣的體積=$\frac{0.04mol}{2}$=448mL<672mL,所以陽極上還有224mL氧氣,陽極上轉移電子的物質的量=0.04mol×1+$\frac{0.224L}{22.4L/mol}$=0.08mol,陰極上銅完全析出時,需要電子的物質的量=0.04mol×2=0.08mol,所以陰極上不析出氫氣,生成224mL氧氣時,陽極附近同時生成C(H+)=$\frac{\frac{0.224}{22.4}mol×4}{0.4L}$=0.1mol/L,所以溶液的pH=1,故答案為:1;
③工業精煉銅時,陽極是粗銅,電解液為含銅離子的溶液CuSO4或CuCl2,故答案為:CuSO4或CuCl2;Y.
點評 本題考查構成原電池的條件、電解池的有關計算等知識點,難點是(4)中溶液pH的計算,只有明確陰陽極上析出的物質才能正確解答,為易錯點.


 輕松課堂單元期中期末專題沖刺100分系列答案
輕松課堂單元期中期末專題沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | 金屬性強弱:Na>Mg>Al | B. | 熱穩定性:HCl>H2 S>PH3 | ||
| C. | 酸性強弱:HClO4>H2 SO4>H3PO4 | D. | 熔點:Na>SiO2>CO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+、Na+、SCN-、Cl- | B. | Na+、H+、NO3-、SO42- | ||
| C. | Na+、OH-、H+、NO3- | D. | Fe2+、NH4+、Cl-、OH- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②④⑤ | B. | ①⑤⑥ | C. | ①③④⑥ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗小組為探究SO2的漂白性和還原性,設計了以下實驗.
實驗小組為探究SO2的漂白性和還原性,設計了以下實驗.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
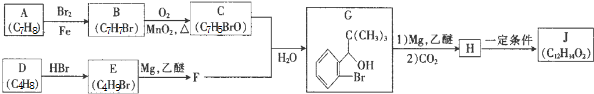
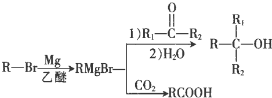
 +Br2$\stackrel{鐵粉}{→}$
+Br2$\stackrel{鐵粉}{→}$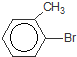 +HBr.,其反應類型為取代反應;
+HBr.,其反應類型為取代反應;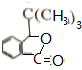 ,由D生成E的化學反應方程式為CH2=C(CH3)2+HBr→(CH3)3CBr;
,由D生成E的化學反應方程式為CH2=C(CH3)2+HBr→(CH3)3CBr;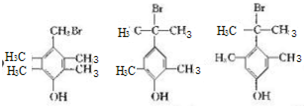 (其中一種)(寫出一種即可).
(其中一種)(寫出一種即可).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 麥芽糖水解的產物只有葡萄糖 | |
| B. | 苯酚可用于合成高分子化合物 | |
| C. | 油脂水解可以制取高級脂肪酸 | |
| D. | 雞蛋清遇醋酸鉛后產生的沉淀能重新溶于水 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com