
 隨著我國工業化水平的不斷發展,研究空氣污染、廢水處理等問題成為重要課題.
隨著我國工業化水平的不斷發展,研究空氣污染、廢水處理等問題成為重要課題.分析 (1)①得電子,化合價降低的反應物是氧化劑;
②根據化合價升降總數相等、原子守恒來配平;
(2)HCN為弱酸,NaCN溶液水解溶液顯顯堿性;HCN的Ka=6.17×10-10,根據其水解方程式CN-+H2O?HCN+OH-,得水解平衡常數Kh=$\frac{{K}_{w}}{{K}_{a}}$計算;
(3))①醋酸的酸性大于碳酸的酸性,小于草酸的酸性,故醋酸與CaC2O4不反應,與CaCO3反應有氣泡逸出;
②該反應的K=$\frac{c({C}_{2}{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({C}_{2}{{O}_{4}}^{2-})•c(C{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(C{a}^{2+})}$=$\frac{Ksp(Ca{C}_{2}{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{5.0×1{0}^{-9}}{2.5×1{0}^{-9}}$=2.0,設c(CO32-)轉化了x,則生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
結合K的表達式計算.
解答 解:(1)①由圖甲可知SCR技術中NH3與NO、NO2反應產物為N2和水,故氧化劑為NO、NO2,故答案為:NO、NO2;
②NH3中氮的化合價由-3價升高到0價,一個NH3失去3個電子,NO2中氮的化合價由+4價降低到0價,一個NO2得到4個電子,NO中氮的化合價由+2價降低到0價,一個NO得到2個電子,當NO2與NO的物質的量之比為1:1時,轉移電子的最小公倍數為6,結合質量守恒可知方程式為:2NH3+NO+NO2=2N2+3H2O;每有1molNO反應轉移電子6mol,所以有3mol電子發生轉移時,生成NO0.5mol,故答案為:2NH3+NO+NO2=2N2+3H2O;0.5mol;
(2)HCN為弱酸,NaCN溶液水解溶液顯顯堿性,水解方程式為:CN-+H2O?HCN+OH-,根據其水解方程式CN-+H2O?HCN+OH-,pH=9,則c(OH-)=10-5mol/L,得水解平衡常數Kh=$\frac{{K}_{w}}{{K}_{a}}$=$\frac{1{0}^{-14}}{6.17×1{0}^{-10}}$=$\frac{c(O{H}^{-})c(HCN)}{c(C{N}^{-})}$=$\frac{1{0}^{-5}c(HCN)}{c(C{N}^{-})}$,則$\frac{c(C{N}^{-})}{c(HCN)}$=6.17×10-1,故答案為:CN-+H2O?HCN+OH-;<;
(3)①醋酸的酸性大于碳酸的酸性,小于草酸的酸性,故醋酸與CaC2O4不反應,與CaCO3反應有氣泡逸出;
故答案為:一種固體溶解同時產生氣泡逸出,另一種固體無現象;
②K=$\frac{c({C}_{2}{{O}_{4}}^{2-})}{c(C{{O}_{3}}^{2-})}$=$\frac{c({C}_{2}{{O}_{4}}^{2-})•c(C{a}^{2+})}{c(C{{O}_{3}}^{2-})•c(C{a}^{2+})}$=$\frac{Ksp(Ca{C}_{2}{O}_{4})}{Ksp(CaC{O}_{3})}$=$\frac{5.0×1{0}^{-9}}{2.5×1{0}^{-9}}$=2.0,
設c(CO32-)轉化了x,則生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
可得方程:$\frac{x}{0.6-x}$=2.0,解得x=0.4 mol•L?1;
故答案為:0.4 mol•L?1.
點評 本題考查了氧化還原反應中氧化劑和還原劑判斷、氧化還原方程式書寫、水解平衡常數計算、弱酸的性質等知識,綜合性較強,難度中等.


科目:高中化學 來源: 題型:選擇題
| A. | 濃鹽酸、濃硫酸、濃硝酸均具有氧化性,都屬于氧化性酸 | |
| B. | Na2O、SO2、BaSO4在熔融狀態或溶于水時均能導電,都屬于電解質 | |
| C. | NaOH、HNO3、NaNO3在水溶液中均能電離出離子,都屬于離子化合物 | |
| D. | 金剛石、二氧化硅、碳化硅晶體中原子間均以共價鍵結合,都屬于原子晶體 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氧氣 | B. | 二氧化硫 | ||
| C. | 二氧化氮和氧氣 | D. | 二氧化氮和一氧化氮 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 組別 | 10%硫酸體積/mL | 溫度/℃ | 其他物質 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴飽和X溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸餾水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
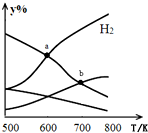 以二氧化碳和氫氣為原料制取乙醇的反應為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3CH2OH(g)+3H2O(g)△H<0某壓強下的密閉容器中,按CO2和H2的物質的量比為1:3投料,不同溫度下平衡體系中各物質的物質的量百分數(y%)隨溫度變化如圖所示.下列說法正確的是( )
以二氧化碳和氫氣為原料制取乙醇的反應為:2CO2(g)+6H2(g)$\stackrel{催化劑}{?}$CH3CH2OH(g)+3H2O(g)△H<0某壓強下的密閉容器中,按CO2和H2的物質的量比為1:3投料,不同溫度下平衡體系中各物質的物質的量百分數(y%)隨溫度變化如圖所示.下列說法正確的是( )| A. | a點的平衡常數小于b點 | |
| B. | b點,v正(CO2)=v逆(H2O) | |
| C. | a點,H2和H2O物質的量相等 | |
| D. | 其他條件恒定,充入更多H2,v(CO2)不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 放Na2CO3的一端托盤下沉 | B. | 放NaHCO3的端托盤下沉 | ||
| C. | 仍保持平衡 | D. | 無法判斷 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 步驟Ⅰ中的試劑甲必須具有較強的還原性 | |
| B. | 步驟Ⅲ發生反應的離子方程式為:2ClO3-+5Mn2++4H2O=5MnO2+Cl2↑+8H+ | |
| C. | 若用電解法,則MnO2將在陽極產生,電極反應式為Mn2+-2e-+2H2O═MnO2+4H+ | |
| D. | 測定步驟Ⅰ所得溶液中Mn2+的含量可采用先將Mn2+轉化為Mn,然后再用0.1 mol•L-1HCl標準溶液滴定的方法 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com