
| A. | 放Na2CO3的一端托盤下沉 | B. | 放NaHCO3的端托盤下沉 | ||
| C. | 仍保持平衡 | D. | 無法判斷 |
分析 在天平的兩個托盤上,放上質量相等的兩個燒杯,在燒杯中分別加入等質量等濃度的硫酸,此時天平處于平衡狀態,然后分別向兩只燒杯中加入等質量的Na2CO3和NaHCO3粉末,反應物放在一起不反應的狀態時,天平是平衡的,指針的偏轉主要是看生成二氧化碳的多少,因此解題時判斷二氧化碳多少則成為解題的關鍵所在,所以可計算相同質量的Na2CO3和NaHCO3完全反應放出二氧化碳質量的大小,天平的指針會偏向質量大(下沉)的一方.
解答 解:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑,根據化學方程式,利用關系式法計算加入碳酸鈉,溶液質量的變化.
Na2CO3~CO2↑ 溶液質量增加(△m)
106 44 62
106g 62g
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑,根據化學方程式,利用關系式法計算加入碳酸氫鈉,溶液質量的變化.
NaHCO3~CO2↑ 溶液質量增加(△m)
84 44 40
106g m
m=$\frac{106g×40}{84}$=50.5g,所以加入碳酸鈉一端溶液質量增重大,故放Na2CO3的一端托盤下沉,
故選:A.
點評 本題是比較抽象的根據化學方程式的計算,解本題的關鍵是分析左右兩盤實際質量的變化,題目難度中等.


科目:高中化學 來源: 題型:解答題
 在容積為100L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2 (g),隨溫度升高,混合氣體的顏色變深.反應的△H大于0(填“大于”或“小于”);100℃時,體系中各物質濃度隨時間變化如圖所示.在0~60s時段,反應速率v(N2O4)為0.0010mol/(L•s).
在容積為100L的容器中,通入一定量的N2O4,發生反應N2O4(g)?2NO2 (g),隨溫度升高,混合氣體的顏色變深.反應的△H大于0(填“大于”或“小于”);100℃時,體系中各物質濃度隨時間變化如圖所示.在0~60s時段,反應速率v(N2O4)為0.0010mol/(L•s).查看答案和解析>>
科目:高中化學 來源: 題型:填空題
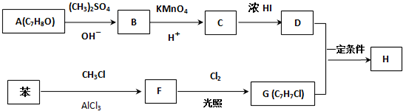

 .
. .
. .
. .
.

 ,反應條件3所用的試劑為濃HI.
,反應條件3所用的試劑為濃HI.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 隨著我國工業化水平的不斷發展,研究空氣污染、廢水處理等問題成為重要課題.
隨著我國工業化水平的不斷發展,研究空氣污染、廢水處理等問題成為重要課題.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
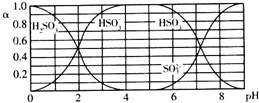
| A. | 溶液的pH=5時,硫元素的主要存在形式為HSO3- | |
| B. | 當溶液恰好呈中性時:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)減小 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題

| 熔點/℃ | 沸點/℃ | 其他 | |
| 黃磷 | 44.1 | 280.5 | 2P(過量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(過量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | FeCl2酸性溶液放在空氣中變質:2Fe2++4H++O2═2Fe3++2H2O | |
| B. | 用酸性K2Cr2O7溶液檢驗酒精:3CH3CH2OH+2Cr2O72-+13H+═4Cr3++11H2O+3CH3COO- | |
| C. | 用惰性電極電解CuSO4溶液:2Cu2++2H2O$\frac{\underline{\;電解\;}}{\;}$2Cu+O2↑+4H+ | |
| D. | 鋼鐵發生吸氧腐蝕時,鐵作負極被氧化:Fe-3e-═Fe3+ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 ,與過量的酸性KMnO4溶液作用,得到下列三種化合物:
,與過量的酸性KMnO4溶液作用,得到下列三種化合物: 、
、 和
和 .化合物乙是甲的同分異構體,乙與過量的酸性KMnO4溶液作用,得到和甲相同的產物.乙的結構簡式為( )
.化合物乙是甲的同分異構體,乙與過量的酸性KMnO4溶液作用,得到和甲相同的產物.乙的結構簡式為( )| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com