
| A. | 醋酸 | B. | 碳酸鈉溶液 | C. | CuSO4溶液 | D. | KCl溶液 |
分析 n[Ba(OH)2]=$\frac{17.1g}{171g/mol}$=0.1mol,溶液中溶質的物質的量=1mol/L×0.1L=0.1mol,溶液導電性強弱與離子濃度成正比,離子濃度變化最小,則溶液導電性變化最小,據此分析解答.
解答 解:n[Ba(OH)2]=$\frac{17.1g}{171g/mol}$=0.1mol,溶液中溶質的物質的量=1mol/L×0.1L=0.1mol,溶液導電性強弱與離子濃度成正比,離子濃度變化最小,則溶液導電性變化最小,
A.醋酸是弱電解質,醋酸溶液中離子濃度較小,則醋酸溶液導電性較弱,加入氫氧化鋇后生成強電解質醋酸鋇,導致離子濃度變化較大,溶液導電性變化較大,故A不選;
B.碳酸鈉是強電解質,離子濃度較大,導電性較強,加入氫氧化鋇后生成碳酸鋇和氫氧化鈉,NaOH仍然是強電解質,離子濃度變化不大,溶液導電性變化不大,故B選;
C.硫酸銅是強電解質,離子濃度較大,導電性較強,加入氫氧化鋇后生成硫酸鋇沉淀和水,離子濃度變化較大,溶液導電性變化較大,故C不選;
D.KCl是強電解質,離子濃度較大,導電性較強,加入氫氧化鋇后二者不反應,離子濃度變化較大,溶液導電性變化較大,故D不選;
故選B.
點評 本題考查溶液導電性強弱判斷,為高頻考點,側重考查學生分析判斷能力,明確溶液導電性強弱影響因素及物質之間的反應是解本題關鍵,溶液導電性強弱與離子濃度成正比,與電解質強弱無關.


科目:高中化學 來源: 題型:選擇題
| A. | 含大量SO2的溶液中:NH4+、F-、HCO3-、ClO- | |
| B. | 能使淀粉碘化鉀試紙變藍的溶液:Cl-、Na+、S2-、NH4+ | |
| C. | $\frac{{k}_{w}}{c({H}^{+})}$=10-13mol/L的溶液中:Al3+、Fe3+、NO3-、ClO4- | |
| D. | 滴入KSCN溶液顯紅色的溶液中:NO3+、Na+、AlO2-、K+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 編號 | 熱化學方程式 | 化學平衡常數 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ/mol | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ/mol | K3 |
| 化學鍵 | H-H | C≡O | C-O | H-O | C-H |
| E/(kJ/mol) | 436 | 1076 | 343 | 465 | 413 |
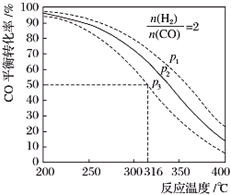
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4:9:24:14:28 | B. | 1:2:5:3:6 | C. | 8:9:12:10:20 | D. | l:l:l:l:2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 9種、7種、6種 | B. | 9種、5種、6種 | C. | 7種、5種、4種 | D. | 8種、5種、5種 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鉛蓄電池屬于二次電池,在充電過程中,陽極質量減小,陰極質量增加 | |
| B. | 常溫下,能自發進行的反應,△H一定小于“0” | |
| C. | 一定條件下,使用催化劑能加快反應速率并提高反應物的活化能 | |
| D. | 相同條件下,溶液中Fe3+、Cu2+、Zn2+的氧化性依次減弱 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 由元素X與Z形成的化合物中只含共價鍵 | |
| B. | XY2、ZY2、M2Y2的晶體分別屬于3種不同類型的晶體 | |
| C. | 單質M的晶體是體心立方堆積,M的配位數是8 | |
| D. | X的氫化物X2H2分子中含有2個σ鍵和3個π鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com