

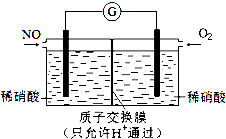
| A. | 正極反應為Cl2+2e-=2Cl- | |
| B. | 放電時,交換膜右側溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替鹽酸,則電池總反應隨之改變 | |
| D. | 當電路中轉移0.01 mol e-時,交換膜左側溶液中約減少0.01 mol離子 |
分析 根據電池總反應為2Ag+Cl2═2AgCl可知,Ag失電子作負極失電子,氯氣在正極上得電子生成氯離子,
A、正極上氯氣得電子;
B、放電時,交換膜左則的氫離子向正極移動,氯離子向負極移動;
C、根據電池總反應判斷;
D、放電時,交換膜左側溶液中生成銀離子.
解答 解:根據電池總反應為2Ag+Cl2═2AgCl可知,Ag失電子作負極失電子,氯氣在正極上得電子生成氯離子,
A、正極上氯氣得電子生成氯離子,其電極反應為:Cl2+2e-═2Cl-,故A正確;
B、放電時,交換膜左則的氫離子向正極移動,所以H+從左側經陽離子交換膜移向右側,氯離子向負極(左側)移動,與負極產物生成白色沉淀氯化銀,故B錯誤;
C、根據電池總反應為2Ag+Cl2═2AgCl可知,用NaCl溶液代替鹽酸,電池的總反應不變,故C錯誤;
D、放電時,當電路中轉移0.01mol e-時,交換膜左則會有0.01mol氫離子通過陽離子交換膜向正極移動,同時會有0.01molAg失去0.01mol電子生成銀離子,銀離子會與氯離子反應生成氯化銀沉淀,所以氯離子會減少0.01mol,則交換膜左側溶液中共約減少0.02mol離子,故D錯誤;
故選A.
點評 本題考查了原電池原理的應用及沉淀反應,注意把握原電池原理及正負極的判斷和電極方程式的書寫,利用電子及電荷守恒來解決原電池中有關計算的問題,題目難度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:選擇題
| A. | 大于10.00mL | B. | 小于10.00Ml | C. | 等于10.00mL | D. | 不能確定 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 鹽酸中逐滴加入食鹽溶液 | B. | 硫酸中逐滴加入氫氧化鈉溶液 | ||
| C. | 石灰乳中滴加稀鹽酸 | D. | 硫酸中逐滴加入氫氧化鋇溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
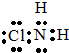 ,從物質結構的角度解釋兩者熔點相差較大的原因氯胺NH2Cl為分子晶體,NH4Cl為離子晶體,熔沸點離子晶體高于分子晶體.
,從物質結構的角度解釋兩者熔點相差較大的原因氯胺NH2Cl為分子晶體,NH4Cl為離子晶體,熔沸點離子晶體高于分子晶體.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 NO和NO2是常見的氮氧化物,研究它們的綜合利用有重要意義.
NO和NO2是常見的氮氧化物,研究它們的綜合利用有重要意義.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 水是強電解質 | B. | 25℃時,純水的pH=7 | ||
| C. | 可燃冰是可以燃燒的水 | D. | 氫氧兩種元素只能組成水 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | .甲溶液含有OH- | B. | .乙溶液含有H+ | C. | 丙溶液含有HCO3- | D. | .丁溶液含有NH4+ |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:
如圖表示一個電解池,裝有電解液a;X、Y是兩塊電極板,通過導線與直流電源相連.請回答以下問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 固態氯化鈉不導電,所以NaCl是非電解質 | |
| B. | 氨氣的水溶液能導電,所以氨氣是電解質 | |
| C. | SO3溶于水能導電,是因為SO3在水中發生了電離 | |
| D. | 液態氯化氫不導電,但是HCl是電解質 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com