
| A. | 鹽酸中逐滴加入食鹽溶液 | B. | 硫酸中逐滴加入氫氧化鈉溶液 | ||
| C. | 石灰乳中滴加稀鹽酸 | D. | 硫酸中逐滴加入氫氧化鋇溶液 |
分析 溶液的導電性和自由移動離子的濃度大小有關,若向某一電解質溶液中逐滴加入另一溶液時,加入物質能與溶液中電解質反應生成弱電解質或沉淀,溶液中電解質的濃度降低,不導電說明完全反應時溶液電荷濃度接近0,當另一溶液過量時,溶液中電荷濃度逐漸增大,又逐漸增強.
解答 解:A.HCl是強電解質,在水溶液里完全電離,加入NaCl后,二者不反應,溶液中電荷濃度不是0,所以不會不導電,故A錯誤;
B.硫酸和NaOH都是強電解質,二者發生反應H2SO4+2NaOH=Na2SO4+H2O,生成的硫酸鈉是強電解質,溶液中離子濃度減小,所以導電能力減弱,但不會出現不導電的情況,故B錯誤;
C.石灰乳和鹽酸反應生成氯化鈣和水,導電能力增加,但是不會出現不能導電的情況,故C錯誤;
D.硫酸和氫氧化鋇都是強電解質,二者發生反應Ba(OH)2+H2SO4=BaSO4↓+2H2O,反應后生成難溶物和弱電解質,溶液中離子濃度逐漸減小,溶液的導電性由大變小,二者恰好反應時離子濃度最小,不導電,再繼續滴加氫氧化鋇,溶液中離子濃度增大,導電能力會增加,符合題意,故D正確;
故選D.
點評 本題考查電解質的電離及離子反應,明確溶液導電性與離子濃度關系是解本題關鍵,溶液導電性與離子濃度、電荷有關,與電解質強弱無關,為易錯點.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:解答題
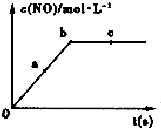 氮元素的單質及其化合物的研究和應用在工農業生產中有著非常重要的地位、工業制硝酸的主要反應之一是:
氮元素的單質及其化合物的研究和應用在工農業生產中有著非常重要的地位、工業制硝酸的主要反應之一是:| 深度/mol•L-1 時間/min | C(NH3) | c(O2) | c(NO) | c(H2O) |
| 起始 | 4.0 | 5.5 | 0 | 0 |
| 第2min | 3.2 | 4.5 | 0.8 | 1.2 |
| 第4min | 2.0 | 3.0 | 2.0 | 3.0 |
| 第6min | 2.0 | 3.0 | 2.0 | 3.0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氨水能跟氯化鐵溶液反應生成氫氧化鐵 | |
| B. | 銨鹽受熱易分解 | |
| C. | 0.1 mol/L氯化銨溶液的pH約為5 | |
| D. | 0.1 mol/L氨水可使酚酞試液變紅 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| A. | 一定存在SO42-、CO32-、NH4+,可能存在K+、Cl-、Na+ | |
| B. | 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在K+、Na+ | |
| C. | c(CO32-)=0.01 mol•L-1,c(NH4+)>c(SO42-) | |
| D. | 如果上述6種離子都存在,則c(Cl-)>c(SO42-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 溶液中Cu2+濃度增大 | B. | 溶液中Cu2+數目增大 | ||
| C. | 該硫酸銅晶體體積不變 | D. | 溶液的藍色不變 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
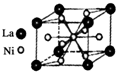 目前,利用金屬或合金儲氫已取得很大進展,先后發現了Ni、Mg、Fe基三個系列的儲氫材料,如圖是一種儲氫密度超過液氫的鎳基合金的晶胞結構圖.
目前,利用金屬或合金儲氫已取得很大進展,先后發現了Ni、Mg、Fe基三個系列的儲氫材料,如圖是一種儲氫密度超過液氫的鎳基合金的晶胞結構圖.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 正極反應為Cl2+2e-=2Cl- | |
| B. | 放電時,交換膜右側溶液中有大量白色沉淀生成 | |
| C. | 若用NaCl溶液代替鹽酸,則電池總反應隨之改變 | |
| D. | 當電路中轉移0.01 mol e-時,交換膜左側溶液中約減少0.01 mol離子 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1:2:3 | B. | 3:2:1 | C. | 1:1:1 | D. | 6:3:2 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com