

分析 (1)①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(l)?H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根據蓋斯定律,方程式①-3×②-2×③得到方程2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(l),據此計算△H;
(2)當反應達到平衡狀態時,正逆反應速率相等,各物質的濃度、百分含量不變,以及由此衍生的一些量也不發生變化,解題時要注意,選擇判斷的物理量,隨著反應的進行發生變化,當該物理量由變化到定值時,說明可逆反應到達平衡狀態;
(3)①由圖1可知,壓強一定時,溫度越高CO的轉化率越小,說明升高溫度平衡向逆反應方向移動;
②平衡常數與濃度、壓強無關,只與溫度有關,結合平衡移動判斷;增大壓強平衡正移,CO的轉化率增大;
③A、B兩點溫度相等,壓強不同,平衡常數相同,利用三段式計算A、B兩點平衡時各組分物質的量,根據A點各物質的濃度計算平衡常數,再根據平衡常數計算B點體積;
(4)①由圖可知,在4.0×106Pa時轉化率相對比較大,再增大壓強,轉化率增大不多,會對設備要求較大;
②由圖可知,高于80℃時,溫度對反應速率影響較小;且反應放熱,升高溫度時平衡逆向移動,轉化率降低.
解答 解:(1)已知:①2CO(g)+4H2(g)?CH3CH2OH(g)+H2O(g)△H1
②H2O(1)═H2O(g)△H2
③CO(g)+H2O(g)?CO2(g)+H2(g)△H3
根據蓋斯定律,則①-②×3-③×2得2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O,則:△H=△H1-3△H2-2△H3,
故答案為:H=△H1-3△H2-2△H3;
(2)a.v(H2)正=2v(CO)逆與化學計量數對應成比例,能說明達到平衡,故a正確;
b.平衡常數與濃度、壓強無關,只與溫度有關,溫度一定時平衡常數為定值,絕熱密閉容器中,容器中的溫度隨著反應進行不斷變化,則平衡常數不斷變化,當平衡常數不變時說明達到了平衡狀態,故b正確;
c.容器體積不變,混合氣體總質量不變,混合氣體密度始終保持不變,不能說明得到平衡,故c錯誤;
d.隨著反應的進行,CH3OCH3和H2O的體積之比始終不隨時間而變化,無法說明反應到達平衡,故d錯誤,
故答案為:a、b;
(3)①由圖1可知,壓強一定時,溫度越高CO的轉化率越小,說明升高溫度平衡向逆反應方向移動,即正反應為放熱反應,故答案為:放熱;
②平衡常數與壓強無關,只與溫度有關,A、B溫度相等,則KA=KB,相同壓強下,溫度越高CO的轉化率越小,說明升高溫度平衡向逆反應方向移動,則平衡常數減小,故KB>KC,故KA=KB>KC;增大壓強平衡正移,CO的轉化率增大,已知P2條件下,CO的轉化率大,則P1<P2;
故答案為:KA=KB>KC; P1<P2;
③A、B兩點溫度相等,壓強不同,平衡常數相同,
對應A點,CO轉化率為0.5,參加反應CO為10mol×0.5=5mol,
CO(g)+2H2(g)?CH3OH(g)
開始(mol):10 20 0
轉化(mol):5 10 5
平衡(mol):5 10 5
故T1溫度下,平衡常數K=$\frac{\frac{5}{10}}{\frac{5}{10}×(\frac{10}{10})^{2}}$=1
對應B點,CO轉化率為0.8,參加反應CO為10mol×0.8=8mol,
CO(g)+2H2(g)?CH3OH(g)
開始(mol):10 20 0
轉化(mol):8 16 8
平衡(mol):2 4 8
設平衡時的體積為VL,則$\frac{\frac{8}{V}}{\frac{2}{V}×(\frac{4}{V})^{2}}$=1,解得V=2
故答案為:2;
(4)①從反應壓強對甲醇轉化率的影響“效率“看,圖象中轉化率變化最大的是34.0×106Pa,再增大壓強,轉化率增大不多,會對設備要求較大,因選擇壓強:4.0×106Pa,
故答案為:4.0×106Pa;
②由圖可知,溫度在高于80°C對反應速率影響不大,反應是放熱反應,溫度過高,平衡逆向進行,甲醇轉化率會降低,
故答案為:高于80℃時,溫度對反應速率影響較小,且反應放熱,升高溫度時平衡逆向移動,轉化率降低.
點評 本題考查化學平衡常數有關計算、化學平衡圖象及影響因素、化學平衡狀態判斷、反應熱計算,注意掌握化學平衡常數的應用,掌握三段式計算方法,難度中等.


 鷹派教輔銜接教材河北教育出版社系列答案
鷹派教輔銜接教材河北教育出版社系列答案 初中暑期銜接系列答案
初中暑期銜接系列答案科目:高中化學 來源: 題型:選擇題
| A. | X的氣態氫化物的熱穩定性比O(氧)的強 | |
| B. | 元素Z、W的簡單離子具有相同的電子層結構 | |
| C. | Y、Z、W的最高價氧化物對應的水化物之間能相互反應 | |
| D. | 等質量的Y和Z單質分別與足量稀鹽酸反應,前者產生的氫氣多 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
 2016年8月10日《生物谷》載文稱,“毒性氣體”CO、NO及H2S可作為新型藥物開發的潛在靶點,用以開發更多新型藥物來幫助治療多種人類疾病.下列有關這三種氣體的說法正確的是( )
2016年8月10日《生物谷》載文稱,“毒性氣體”CO、NO及H2S可作為新型藥物開發的潛在靶點,用以開發更多新型藥物來幫助治療多種人類疾病.下列有關這三種氣體的說法正確的是( )| A. | 都是電解質 | B. | 都易溶于水 | ||
| C. | 都能與堿溶液反應 | D. | 都屬于共價化合物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在配制一定物質的量濃度溶液的實驗中量筒是必需儀器 | |
| B. | 實驗室中,盛裝NaOH 溶液的試劑瓶用橡皮塞 | |
| C. | 某未知液中加入稀NaOH溶液,沒有產生使濕潤的紅色石蕊試紙變藍的氣體,則該未知液中不含NH4+ | |
| D. | 用pH試紙測定某溶液的pH時,需預先用蒸餾水濕潤pH 試紙 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
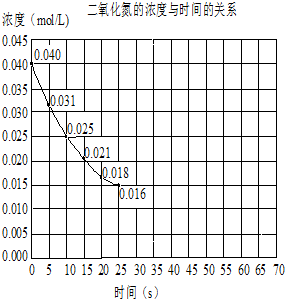
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 溫度/℃ | 25 | 200 | 300 | 400 | 500 |
| K | 5×108 | 1.0 | 0.86 | 0.507 | 0.152 |
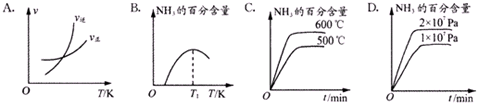
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 700℃ | 900℃ | |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
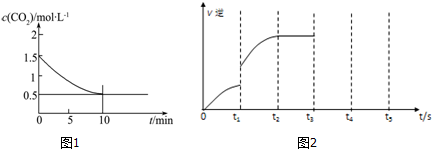
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | ①②⑤ | B. | ②③⑤⑨ | C. | ④⑤⑥⑦ | D. | ②③⑧⑨ |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 28gMgCO3和NaHCO3混合固體中的CO32-離子數為NA | |
| B. | lmolI2與4molH2反應生成的HI分子數為2NA | |
| C. | 1molAl溶于含1molNaOH溶液,電子轉移數為3NA | |
| D. | 標準狀況下,2.24LH2O含有的共價鍵數為0.2NA |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com