
| A. | ①②⑤⑦ | B. | ②③⑥ | C. | ②④ | D. | ②④⑤⑥ |
分析 原電池中,較活潑的金屬作負極,負極上金屬失去電子發生氧化反應,較不活潑的金屬作正極,正極上得電子發生還原反應,外電路上,電子從負極沿導線流向正極,以此解答該題.
解答 解:原電池中,較活潑的金屬銅作負極,負極上金屬銅失去電子發生氧化反應,較不活潑的金屬銀作正極,正極上銀離子得電子發生還原反應,外電路上,電子從負極沿導線流向正極,
①在外電路中,電流由銀電極流向銅電極,故錯誤;
②正極上得電子發生還原反應,所以反應為:Ag++e-=Ag,故正確;
③實驗過程中取出鹽橋,不能構成閉合回路,所以原電池不能繼續工作,故錯誤;
④該原電池的電極反應式為:負極:Cu-2e-=Cu2+正極:Ag++e-=Ag,故總反應為Cu+2Ag+=Cu2++2Ag.銅片與硝酸銀反應的離子方程式為Cu+2Ag+=Cu2++2Ag,與原電池的總反應相同,故正確.
⑥銅為負極,被氧化,銅片質量減小,故錯誤;
⑦銅為負極,被氧化,Cu(NO3)2溶液中的Cu2+濃度逐漸增大,故錯誤.
故選C.
點評 本題考查了原電池原理,難度不大,明確原電池放電時外電路上電流的流向、電極上發生的反應、原電池的構成條件即可分析解答本題.


 全優沖刺100分系列答案
全優沖刺100分系列答案 英才點津系列答案
英才點津系列答案 紅果子三級測試卷系列答案
紅果子三級測試卷系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該氣體分子的摩爾質量為$\frac{22.4m}{{V}_{1}}$g/mol | |
| B. | 該氣體分子中含有的原子數目為$\frac{{N}_{A}{V}_{1}}{22.4}$g/mol | |
| C. | 該氣體溶于水后得到溶液的物質的量濃度為$\frac{m}{M{V}_{2}}$mol/L | |
| D. | 該氣體溶于水后得到溶液的物質的量濃度$\frac{{V}_{1}}{22.4{V}_{2}}$mol/L |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 甲苯和硝酸反應生成三硝基甲苯 | |
| B. | 甲苯能使酸性高錳酸鉀溶液褪色 | |
| C. | 1mol甲苯能與3mol氫氣發生加成反應 | |
| D. | 甲苯可以燃燒并產生濃烈的黑煙 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
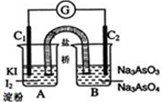 將可逆反應:AsO43-+2I-+2H+?AsO33-+I2+H2O設計成如圖所示的電化學裝置,其中C1、C2均為碳棒.回答下列問題:
將可逆反應:AsO43-+2I-+2H+?AsO33-+I2+H2O設計成如圖所示的電化學裝置,其中C1、C2均為碳棒.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應①是熵減小的反應,而反應②是熵增大的反應 | |
| B. | 反應②高溫時能自發迸行.是由于生成CO2使熵值增大 | |
| C. | 上述事實說明的H2SiO3酸性有時比H2CO3強,有時比H2CO3弱 | |
| D. | H2CO3酸性強于H2SiO3,不能用反應②進行解釋 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com